作成又は改訂年月
**
2016年5月
改訂(第7版)
*
2015年5月
改訂
日本標準商品分類番号
日本標準商品分類番号等
**2016年5月
薬効分類名
ロイコトリエン受容体拮抗剤
気管支喘息治療剤
**アレルギー性鼻炎治療剤
承認等
販売名
プランルカストドライシロップ10%「AFP」
販売名コード
承認・許可番号
21900AMX00558000
PRANLUKAST Dry Syrup 10%「AFP」
薬価基準収載年月
販売開始年月
貯法・使用期限等
組成
*成分・含量
1g中「日本薬局方」プランルカスト水和物100mg
添加物
白糖、トウモロコシデンプン、ヒドロキシプロピルセルロース、アスパルテーム(L-フェニルアラニン化合物)、香料、バニリン、エチルバニリン、アラビアゴム末、デキストリン
| 性 状 | 白色〜微黄色の顆粒で、芳香があり、味は甘い。 |
|---|
一般的名称
禁忌
効能又は効果
用法及び用量
通常、小児にはプランルカスト水和物として1日量7mg/kg(ドライシロップとして70mg/kg)を朝食後および夕食後の2回に分け、用時懸濁して経口投与する。なお、年齢、症状により適宜増減する。1日最高用量はプランルカスト水和物として10mg/kg(ドライシロップとして100mg/kg)とする。ただし、プランルカスト水和物として成人の通常の用量である450mg/日(ドライシロップとして4.5g/日)を超えないこと。
用法及び用量の表
体重別の標準投与量は、通常、下記の用量を1回量とし、1日2回、朝食後および夕食後に経口投与する。
体 重
|
ドライシロップ1回量
|
| 12kg以上 18kg未満 | 0.5g(プランルカスト水和物として50mg) |
| 18kg以上 25kg未満 | 0.7g(プランルカスト水和物として70mg) |
| 25kg以上 35kg未満 | 1.0g(プランルカスト水和物として100mg) |
| 35kg以上 45kg未満 | 1.4g(プランルカスト水和物として140mg) |
使用上の注意
重要な基本的注意
1本剤は気管支拡張剤、ステロイド剤等と異なり、すでに起こっている喘息発作を緩解する薬剤ではないので、このことは患者に十分説明しておく必要がある。
2気管支喘息患者に本剤を投与中、大発作をみた場合は、気管支拡張剤あるいはステロイド剤を投与する必要がある。
3長期ステロイド療法を受けている患者で、本剤投与によりステロイドの減量をはかる場合は十分な管理下で徐々に行うこと。
4本剤投与によりステロイド維持量を減量し得た患者で、本剤の投与を中止する場合は、原疾患再発のおそれがあるので注意すること。
5本剤を含めロイコトリエン拮抗剤使用時にChurg-Strauss症候群様の血管炎を生じたとの報告がある。これらの症状は、おおむね経口ステロイド剤の減量・中止時に生じている。本剤使用時は、特に好酸球数の推移及びしびれ、四肢脱力、発熱、関節痛、肺の浸潤影等の血管炎症状に注意すること。
6他のロイコトリエン拮抗剤を投与した患者で、因果関係は明らかではないがうつ病、自殺念慮、自殺及び攻撃的行動を含む精神症状が報告されているので、本剤の投与にあたっては患者の状態を十分に観察すること。
7**本剤投与により効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。特に、小児の通年性アレルギー性鼻炎については、プランルカスト水和物ドライシロップ製剤の臨床試験において、プラセボ群に対する優越性は示されなかったため、患者の状態を観察し、有益性が認められない場合には漫然と投与しないこと。
8小児では一般に自覚症状を訴える能力が劣るので、本剤の投与に際しては、保護者等に対し、患者の状態を十分に観察し、異常が認められた場合には速やかに主治医に連絡する等の適切な処置をするように注意を与えること。
相互作用
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
| 主にCYP3A4によって代謝される薬剤 | 本剤及びこれらの薬剤の血中濃度が上昇する可能性がある。 | 本剤はin vitro試験でCYP3A4により代謝され、これらの薬剤の代謝を競合的に阻害するとの報告がある。 |
|---|
CYP3A4を阻害する薬剤
イトラコナゾール
エリスロマイシン等 | 本剤の血中濃度が上昇する可能性がある。 | in vitro、in vivo試験でこれらの薬剤により本剤の代謝が阻害されるとの報告がある。 |
|---|
副作用
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
1ショック、アナフィラキシー(頻度不明):
ショック、アナフィラキシーがあらわれることがあるので、観察を十分に行い、血圧低下、意識障害、呼吸困難、発疹等があらわれた場合には投与を中止し、適切な処置を行うこと。
2白血球減少(頻度不明):
白血球減少(初期症状:発熱、咽頭痛、全身倦怠感等)があらわれることがあるので、このような症状があらわれた場合には投与を中止すること。
3血小板減少(頻度不明):
血小板減少(初期症状:紫斑、鼻出血、歯肉出血等の出血傾向)があらわれることがあるので、このような症状があらわれた場合には投与を中止すること。
4肝機能障害(頻度不明):
黄疸、AST(GOT)・ALT(GPT)の著しい上昇等を伴う肝機能障害があらわれることがあるので、観察を十分に行い、このような場合には投与を中止し適切な処置を行うこと。
5間質性肺炎、好酸球性肺炎(頻度不明):
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増加等を伴う間質性肺炎、好酸球性肺炎があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
6横紋筋融解症(頻度不明):
横紋筋融解症があらわれることがあるので、筋肉痛、脱力感、CK(CPK)上昇、血中ミオグロビン上昇等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎不全の発症に注意すること。
その他の副作用
| 頻度不明 |
| 過敏症注) | 発疹、蕁麻疹、多形滲出性紅斑、そう痒等 |
| 精神神経系 | 頭痛、眠気、めまい、けいれん、興奮、不眠、しびれ、ふるえ、不安、味覚異常 |
| 消化器 | 嘔気、嘔吐、腹痛、下痢、胃部不快感、便秘、口内炎、食欲不振、胸やけ、腹部膨満感、舌炎、舌しびれ |
| 循環器 | 潮紅、不整脈(頻脈・心房細動・期外収縮等)、動悸 |
| 肝臓 | AST(GOT)・ALT(GPT)の上昇、ビリルビン上昇、アルカリホスファターゼ上昇等 |
| 筋骨格系 | 関節痛、筋肉痛、四肢痛、こわばり、CK(CPK)上昇 |
| 泌尿器 | 尿潜血、蛋白尿、BUN上昇、頻尿、尿量減少、排尿障害 |
| その他 | 好酸球増多、尿沈渣陽性、出血、発熱、咽喉頭異常感、胸部絞扼感、浮腫、脱毛、倦怠感、生理不順、乳房腫脹・硬結、乳房痛、女性化乳房、トリグリセリド上昇、口渇、耳鳴 |
高齢者への投与
一般に高齢者では生理機能が低下しているので減量するなど注意すること。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上まわると判断される場合にのみ投与すること。[妊娠中の投与に関する安全性は確立していない。]
小児等への投与
低出生体重児、新生児、乳児に対する安全性は確立していない(低出生体重児、新生児に対しては使用経験がなく、乳児に対しては使用経験が少ない)。
薬物動態
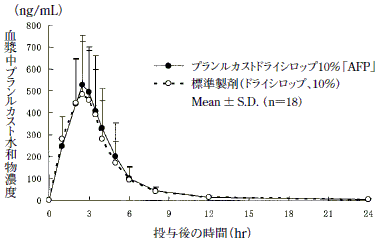
生物学的同等性試験1)
プランルカストドライシロップ10%「AFP」と標準製剤をクロスオーバー法によりそれぞれ2g(プランルカスト水和物として200mg)健康成人男子に空腹時単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された。
(表1参照)
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
薬物動態の表
| AUC0-24
(ng・hr/mL) | Cmax
(ng/mL) | Tmax
(hr) | T1/2
(hr) |
| プランルカストドライシロップ10%「AFP」 | 2120.31±818.79 | 597.08±225.08 | 2.67±0.45 | 3.14±2.54 |
| 標準製剤(ドライシロップ、10%) | 2021.64±760.55 | 581.42±278.42 | 2.61±0.53 | 3.63±2.72 |
**薬効薬理
ロイコトリエン受容体に拮抗し、抗炎症作用、気管支収縮抑制作用を示し、気道過敏症を抑制、また鼻粘膜での抗炎症作用、過敏性抑制作用を示す。2)
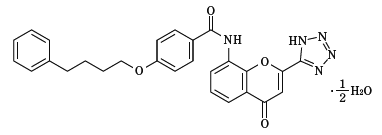
有効成分に関する理化学的知見
一般名
プランルカスト水和物(Pranlukast Hydrate)
*化学名
N-[4-Oxo-2-(1H-tetrazol-5-yl)-4H-chromen-8-yl]-4-(4-phenylbutyloxy)benzamide hemihydrate
*構造式
分子式
C27H23N5O4・1/2H2O
分子量
490.51
*性 状
白色〜淡黄色の結晶性の粉末である。
エタノール(99.5)に極めて溶けにくく、水にほとんど溶けない。
*融 点
約233℃(分解)
取扱い上の注意
安定性試験3)
最終包装製品を用いた加速試験(40℃、相対湿度75%、6カ月)の結果、プランルカストドライシロップ10%「AFP」は通常の市場流通下において3年間安定であることが推測された。
包装
100g、500g
100g(0.5g×200)、140g(0.7g×200)、200g(1g×200)
主要文献及び文献請求先
主要文献
1栗村幸雄 他:医学と薬学,58,99(2007)
2**第十六改正 日本薬局方第二追補解説書,C-230,廣川書店(2014)
3アルフレッサ ファーマ(株):安定性に関する資料(社内資料)
文献請求先
主要文献に記載の社内資料につきましても下記にご請求下さい。
アルフレッサ ファーマ株式会社 学術情報部
〒540-8575 大阪市中央区石町二丁目2番9号
TEL 06-6941-0306 FAX 06-6943-8212
製造販売業者等の氏名又は名称及び住所
製造販売元
アルフレッサ ファーマ株式会社
大阪市中央区石町二丁目2番9号