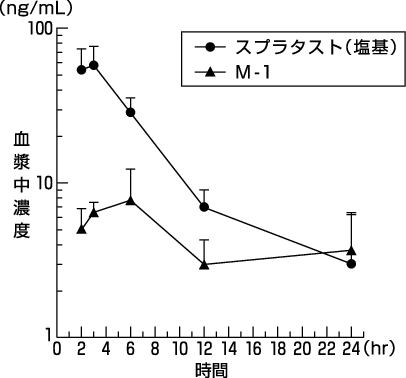
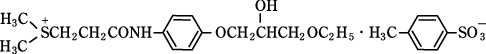1
桑田慶三 他 : 薬物動態. 1992 ; 7(4): 399-421
2
飯倉洋治 他 : アレルギー・免疫. 2001 ; 8(12): 1399-1407
3
丁宗鉄 他 : 基礎と臨床. 1992 ; 26(7): 3199-3215
4
馬場實 他 : 小児気管支喘息に対するIPD-DSの臨床効果―至適用量検討試験―(承認年月日:2001年6月20日、申請資料概要ト.2.(2))
5
馬場實 他 : 小児気管支喘息に対するIPD-DSの長期投与による臨床的検討(承認年月日:2001年6月20日、申請資料概要ト.2.(4))
6
馬場實 他 : 新薬と臨牀. 2003 ; 52(4): 477-503
7
谷口一 他 : アレルギー. 1998 ; 47(8): 720-725
8
Taniguchi, H. et al. : Eur. J. Pharmacol. 1996 ; 318(2-3): 447-454
9
山谷英利 他 : 幼若モルモットにおけるトシル酸スプラタストの気道好酸球浸潤に対する作用(承認年月日:2001年6月20日、申請資料概要ホ.1.(3).1))
10
Yamaya, H. et al. : Life Sci. 1995 ; 56(19): 1647-1654
11
浅香直正 他 : Th2細胞によるマウス腹腔内細胞増多に対するトシル酸スプラタストの作用(承認年月日:2001年6月20日、申請資料概要ホ.1.(3).1))
12
Yanagihara, Y. et al. : Japan. J. Pharmacol. 1993 ; 61(1): 23-30
13
Yanagihara, Y. et al. : Japan. J. Pharmacol. 1993 ; 61(1): 31-39
14
浅香直正 他 : Th2細胞によるマウス腹腔内サイトカイン産生に対するトシル酸スプラタストの作用(承認年月日:2001年6月20日、申請資料概要ホ.1.(3).1))
15
Matsuura, N. et al. : 薬理と治療. 1994 ; 22(3): 1369-1383
16
松浦直資 他 : 日薬理誌. 1992 ; 100(6): 485-493
17
山谷英利 他 : 幼若モルモットにおけるトシル酸スプラタストの気道反応性亢進に対する作用(承認年月日:2001年6月20日、申請資料概要ホ.1.(2).1))
18
山谷英利 他 : 成熟モルモットにおけるトシル酸スプラタストの気道反応性亢進に対する作用(承認年月日:2001年6月20日、申請資料概要ホ.1.(2).1))
19
松浦直資 他 : 薬理と治療. 1992 ; 20(7): 2425-2435
20
Konno, S. et al. : Jpn. J. Allergol. 1995 ; 44(5): 556-561
21
田島清孝 他 : 応用薬理. 1992 ; 43(6): 531-548
22
秋澤有四郎 他 : Suplatast tosilate(IPD-1151T)のchemical mediator拮抗作用, 社内資料, 研究報告書No.76