作成又は改訂年月
日本標準商品分類番号
薬効分類名
承認等
販売名
エピナスチン塩酸塩錠10mg「YD」
販売名コード
承認・許可番号
22500AMX00505
EPINASTINE HYDROCHLORIDE TABLETS
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存、気密容器
使用期限
外箱に表示の使用期限内に使用すること。
注意
取扱い上の注意の項参照。
組成
1錠中、エピナスチン塩酸塩10mgを含有する。
添加物として、乳糖水和物、トウモロコシデンプン、ポビドン、カルメロースCa、無水ケイ酸、ステアリン酸Mg、ヒドロキシプロピルセルロース、タルク、酸化チタンを含有する。
性状
白色〜微黄色のフィルムコーティング錠である。
外形
表
外形
裏
外形
側面
直径(mm)
約6
厚さ(mm)
約3.1
重量(mg)
100
識別コード(PTP)
YD 468
販売名
エピナスチン塩酸塩錠20mg「YD」
販売名コード
承認・許可番号
22500AMX00506
EPINASTINE HYDROCHLORIDE TABLETS
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存、気密容器
使用期限
外箱に表示の使用期限内に使用すること。
注意
取扱い上の注意の項参照。
組成
1錠中、エピナスチン塩酸塩20mgを含有する。
添加物として、乳糖水和物、トウモロコシデンプン、ポビドン、カルメロースCa、無水ケイ酸、ステアリン酸Mg、ヒドロキシプロピルセルロース、エチルセルロース、タルク、酸化チタンを含有する。
性状
白色〜微黄色のフィルムコーティング錠である。
外形
表
外形
裏
外形
側面
直径(mm)
約8.1
厚さ(mm)
約3.4
重量(mg)
180
識別コード(PTP)
YD 469
一般的名称
禁忌
効能・効果
効能又は効果/用法及び用量
気管支喘息
アレルギー性鼻炎
蕁麻疹、湿疹・皮膚炎、皮膚そう痒症、痒疹、そう痒を伴う尋常性乾癬
1気管支喘息、蕁麻疹、湿疹・皮膚炎、皮膚そう痒症、痒疹、そう痒を伴う尋常性乾癬
通常、成人にはエピナスチン塩酸塩として1回20mgを1日1回経口投与する。
なお、年齢、症状により適宜増減する。
2アレルギー性鼻炎
通常、成人にはエピナスチン塩酸塩として1回10〜20mgを1日1回経口投与する。
なお、年齢、症状により適宜増減する。
使用上の注意
慎重投与
肝障害又はその既往歴のある患者
[肝障害が悪化又は再燃することがある。]
重要な基本的注意
1本剤は、気管支拡張剤、ステロイド剤などと異なり、すでに起こっている喘息発作や症状を速やかに軽減する薬剤ではないので、このことは患者に十分説明しておく必要がある。
2長期ステロイド療法を受けている患者で本剤投与によりステロイドの減量をはかる場合は、十分な管理下で徐々に行うこと。
3眠気を催すことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に注意させること。
4本剤を季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
5本剤の使用により効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
副作用
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
1肝機能障害、黄疸(いずれも頻度不明)
AST(GOT)、ALT(GPT)、γ-GTP、Al-P、LDHの上昇等の肝機能障害(初期症状:全身倦怠感、食欲不振、発熱、嘔気・嘔吐等)、黄疸があらわれることがあるので、観察を十分に行い異常が認められた場合には、投与を中止し、適切な処置を行うこと。
2血小板減少(頻度不明)
血小板減少があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
その他の副作用
以下のような副作用があらわれた場合には、症状に応じて適切な処置を行うこと。
過敏症注1)
頻度不明
浮腫(顔面、手足等)、発疹、蕁麻疹、かゆみ、そう痒性紅斑
精神神経系
頻度不明
眠気、倦怠感、頭痛、めまい、不眠、悪夢、しびれ感、頭がボーッとした感じ、幻覚、幻聴
消化器
頻度不明
嘔気、胃部不快感、腹痛、口渇、口内炎、食欲不振、嘔吐、胃重感、胃もたれ感、下痢、便秘、口唇乾燥感、腹部膨満感
腎臓
頻度不明
蛋白尿
泌尿器注2)
頻度不明
頻尿、血尿等の膀胱炎様症状、尿閉
循環器
頻度不明
心悸亢進
呼吸器
頻度不明
呼吸困難、去痰困難、鼻閉
血液注2)
頻度不明
白血球数増加、血小板減少
その他
頻度不明
月経異常、ほてり、にがみ、味覚低下、胸痛、女性型乳房、乳房腫大
その他の副作用の注意
注1)発現した場合には、投与を中止し、適切な処置を行うこと。
注2)観察を十分に行い、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
高齢者への投与
高齢者では肝・腎機能が低下していることが多く、吸収された本剤は主として腎臓から排泄されることから、定期的に副作用・臨床症状(発疹、口渇、胃部不快感等)の観察を行い、異常が認められた場合には、減量(例えば10mg/日)又は休薬するなど適切な処置を行うこと。
妊婦、産婦、授乳婦等への投与
1妊婦又は妊娠している可能性のある婦人には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
[妊娠中の投与に関する安全性は確立していない。また、妊娠前及び妊娠初期試験(ラット)では受胎率の低下が、器官形成期試験(ウサギ)では胎児致死作用が、いずれも高用量で認められている。]
2授乳中の婦人に投与することを避け、やむを得ず投与する場合には授乳を中止させること。
[動物実験(ラット)で母乳中へ移行することが報告されている。]
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない。
適用上の注意
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
その他の注意
本剤を空腹時投与した場合は食後投与よりも血中濃度が高くなることが報告されている。(気管支喘息及びアレルギー性鼻炎に対しては就寝前投与、蕁麻疹、湿疹・皮膚炎、皮膚そう痒症、痒疹、そう痒を伴う尋常性乾癬に対しては食後投与で有効性及び安全性が確認されている。)
薬物動態
エピナスチン塩酸塩錠10mg「YD」
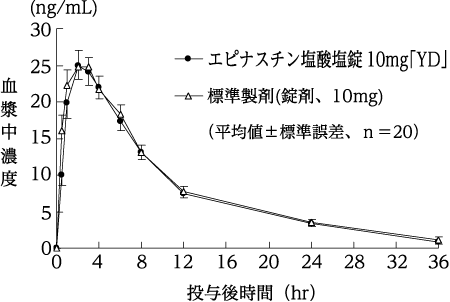
1生物学的同等性試験
エピナスチン塩酸塩錠10mg「YD」と標準製剤をクロスオーバー法によりそれぞれ2錠(エピナスチン塩酸塩として20mg)、健康成人男子20名に絶食単回経口投与して血漿中未変化体濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された。1)
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
2溶出挙動
エピナスチン塩酸塩錠10mg「YD」は、日本薬局方外医薬品規格第3部に定められたエピナスチン塩酸塩錠の溶出規格に適合していることが確認されている。
エピナスチン塩酸塩錠20mg「YD」
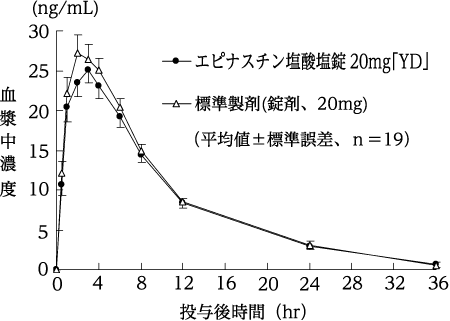
生物学的同等性試験
エピナスチン塩酸塩錠20mg「YD」と標準製剤をクロスオーバー法によりそれぞれ1錠(エピナスチン塩酸塩として20mg)、健康成人男子19名に絶食単回経口投与して血漿中未変化体濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された。2)
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
2溶出挙動
エピナスチン塩酸塩錠20mg「YD」は、日本薬局方外医薬品規格第3部に定められたエピナスチン塩酸塩錠の溶出規格に適合していることが確認されている。
薬物動態の表
| 判定パラメータ | 判定パラメータ | 参考パラメータ | 参考パラメータ |
| | AUC0-36
(ng・hr/mL) | Cmax
(ng/mL) | Tmax
(hr) | t1/2
(hr) |
| エピナスチン塩酸塩錠10mg「YD」 | 280.1±93.9 | 26.8±8.4 | 2.4±0.9 | 7.9±2.3 |
| 標準製剤(錠剤、10mg) | 294.3±94.0 | 27.6±6.9 | 2.2±1.1 | 8.3±2.3 |
| 判定パラメータ | 判定パラメータ | 参考パラメータ | 参考パラメータ |
| | AUC0-36
(ng・hr/mL) | Cmax
(ng/mL) | Tmax
(hr) | t1/2
(hr) |
| エピナスチン塩酸塩錠20mg「YD」 | 291.4±87.4 | 26.9±6.8 | 2.6±0.9 | 7.0±2.2 |
| 標準製剤(錠剤、20mg) | 308.0±75.7 | 29.3±7.6 | 2.7±0.9 | 7.0±2.1 |
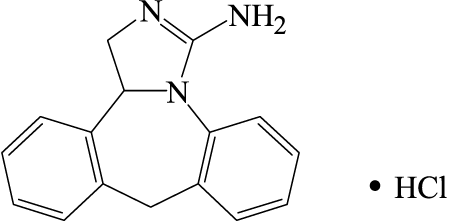
有効成分に関する理化学的知見
一般名
エピナスチン塩酸塩(Epinastine Hydrochloride)
化学名
(±)-3-Amino-9,13b-dihydro-1H-dibenz[c,f]imidazo[1,5-a]azepine hydrochloride
分子式
C16H15N3・HCl
分子量
285.77
構造式
性状
白色〜微黄色の粉末で、においはなく、味は苦い。
水、メタノール、エタノール(99.5)又は酢酸(100)に溶けやすく、アセトニトリルに溶けにくく、ジエチルエーテルにほとんど溶けない。
水溶液(1→20)は旋光性がない。
取扱い上の注意
エピナスチン塩酸塩錠10mg「YD」
1保管方法
アルミピロー開封後は光及び湿気を避けて保存し、なるべく速やかに使用して下さい。
2安定性試験
最終包装製品を用いた長期保存試験の結果、外観及び含量等は規格の範囲内であり、エピナスチン塩酸塩錠10mg「YD」は通常の市場流通下において3年間安定であることが確認された。3)
エピナスチン塩酸塩錠20mg「YD」
1保管方法
アルミピロー開封後は光及び湿気を避けて保存し、なるべく速やかに使用して下さい。
2安定性試験
最終包装製品を用いた長期保存試験の結果、外観及び含量等は規格の範囲内であり、エピナスチン塩酸塩錠20mg「YD」は通常の市場流通下において3年間安定であることが確認された。4)
包装
エピナスチン塩酸塩錠10mg「YD」
PTP:100錠
エピナスチン塩酸塩錠20mg「YD」
PTP:100錠、500錠
主要文献及び文献請求先
主要文献
1
(株)陽進堂社内資料:生物学的同等性試験
2
(株)陽進堂社内資料:生物学的同等性試験
3
(株)陽進堂社内資料:安定性試験
4
(株)陽進堂社内資料:安定性試験
文献請求先
主要文献に記載の社内資料につきましても下記にご請求下さい。
共創未来ファーマ株式会社 お客様相談室
〒155-8655 東京都世田谷区代沢5-2-1
TEL:050-3383-3846
製造販売業者等の氏名又は名称及び所在地
製造販売元
株式会社 陽進堂
富山県富山市婦中町萩島3697番地8号
販売元
共創未来ファーマ株式会社
東京都品川区広町1-4-4