1
酒井孝範他.:薬物動態.1987;2:147-154.
2
中島重徳他.:基礎と臨床.1989;23:5431-5440.
3
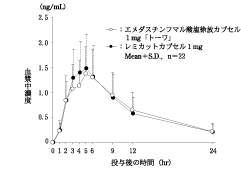
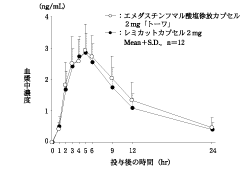
社内資料:生物学的同等性試験(カプセル1mg)
4
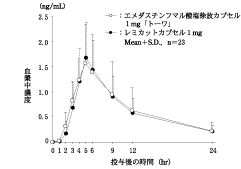
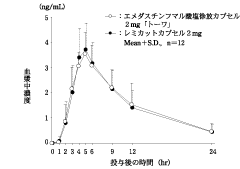
社内資料:生物学的同等性試験(カプセル2mg)
5
酒井孝範他.:薬物動態.1987;2:123-131.
6
酒井孝範他.:薬物動態.1987;2:133-145.
7
第十八改正日本薬局方解説書.2021;C-1066-1070.
8
浜田司他.:薬物動態.1990;5:871-881.
9
粟田則男他.:薬学雑誌.1989;109:318-328.
10
和田幸雄他.:薬物動態.1989;4:459-470.
11
和田幸雄他.:薬物動態.1989;4:471-480.
12
奥田稔他.:耳鼻咽喉科展望.1990;33(補2):113-131.
13
奥田稔他.:耳鼻咽喉科展望.1990;33(補4):543-565.
14
石橋康正他.:臨床医薬.1989;5:2291-2309.
15
石橋康正他.:臨床医薬.1994;10:1919-1935.
16
石橋康正他.:臨床医薬.1990;6:141-159.
17
KG-2413 研究班.:西日本皮膚科.1995;57:325-334.
18
堀尾武他.:皮膚科紀要.1989;84:653-661.
19
井階幸一他.:皮膚科紀要.1994;89:737-747.
20
計盛幸子他.:臨床医薬.1989;5:2311-2320.
21
Fukuda T,et al.:Arzneimittelforschung.1984;34:805-810.
22
斉藤忠之他.:日本薬理学雑誌.1987;89:55-62.
23
斉藤忠之他.:基礎と臨床.1989;23:3145-3147.
24
Fukuda T,et al.:Arzneimittelforschung.1984;34:801-805.
25
Nishimura N,et al.:Immunopharmacol Immunotoxicol.1987;9:511-521.
26
Saito T,et al.:Jpn J Pharmacol.1993;62:137-143.
27
松田直美他.:薬理と治療.1993;21:1475-1478.
28
斉藤忠之他.:西日本皮膚科.1993;55:1081-1085.
29
成田慎一郎他.:耳鼻咽喉科臨床.1996;89:645-649.





 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379

