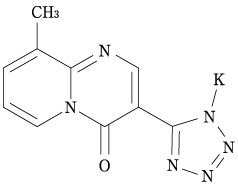
1
金原美穂子 他:薬理と治療 1990;18(3):1035-1040
2
黒沼忠由樹 他:診療と新薬 1990;27(10):1961-1965
3
金原美穂子 他:薬理と治療 1990;18(3):1041-1047
4
西野晴夫 他:薬理と治療 1992;20(3):869-877
5
吉田 尚 他:薬理と治療 1989;17(3):883-905
6
吉田 尚 他:薬理と治療 1989;17(3):907-931
7
吉田 尚 他:薬理と治療 1989;17(3):933-981
8
岡安大仁 他:新薬と臨牀 1989;38(7):1043-1056
9
佐竹辰夫 他:新薬と臨牀 1989;38(7):1058-1068
10
山本正彦 他:新薬と臨牀 1989;38(7):1070-1082
11
馬場 實 他:Progress in Medicine 1990;10(9):2229-2235
12
根本紀夫 他:小児科臨床 1990;43(11):2467-2475
13
三河春樹 他:基礎と臨床 1990;24(15):8093-8100
14
馬場 實 他:小児科臨床 1991;44(4):1071-1093
15
馬場 實 他:小児科臨床 1990;43(11):2477-2484
16
三河春樹 他:基礎と臨床 1990;24(15):8085-8092
17
市村登寿 他:小児科臨床 1991;44(2):401-407
18
奥田 稔 他:耳鼻咽喉科展望 1993;36(2):213-237
19
奥田 稔 他:耳鼻咽喉科展望 1993;36(3):377-401
20
朝倉光司 他:耳鼻と臨床 1993;39(3):469-479
21
石川 哮 他:耳鼻と臨床 1993;39(3):480-493
22
馬場駿吉 他:耳鼻咽喉科展望 1995;38(5):657-676
23
川島敏男 他:アレルギー 1988;37(7):438-447
24
大塚博邦 他:薬理と治療 1992;20(10):4081-4087
25
Y. Yanagihara et al.:Jpn. J. Pharmacol. 1988;48(1):103-112
26
Y. Yanagihara et al.:Jpn. J. Pharmacol. 1989;51(1):83-132
27
T. Kawashima et al.:Pharmacometrics 1993;46(4):265-271
28
Y. Yanagihara et al.:Jpn. J. Pharmacol. 1988;48(1):91-101
29
鈴木義裕 他:応用薬理 1992;44(6):675-678
30
松井秀樹:炎症 1992;12(5):467-473
31
T. Kawashima et al.:Int. Arch. Allergy Immunol. 1994;103:405-409
32
N. Yamashita et al.:Allergology International 1999;48:37-42
33
H. Fujimiya et al.:Int. Arch. Allergy Appl. Immunol. 1991;96:62-67
34
H. Fujimiya et al.:アレルギー, 43, 142(1994)




 227
227
 226
226