添付文書番号
4490004F1129_1_02
企業コード
480235
作成又は改訂年月
日本標準商品分類番号
87449
薬効分類名
アレルギー性疾患治療剤
承認等
販売名
アゼラスチン塩酸塩錠0.5mg「トーワ」
販売名コード
販売名英字表記
AZELASTINE HYDROCHLORIDE TABLETS 0.5mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
販売名
アゼラスチン塩酸塩錠1mg「トーワ」
販売名コード
販売名英字表記
AZELASTINE HYDROCHLORIDE TABLETS 1mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
一般的名称
アゼラスチン塩酸塩錠
組成・性状
組成
アゼラスチン塩酸塩錠0.5mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 アゼラスチン塩酸塩… 0.5mg |
|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、ヒドロキシプロピルセルロース、カルメロースカルシウム、ステアリン酸マグネシウム、ヒプロメロース、タルク、酸化チタン |
|---|
アゼラスチン塩酸塩錠1mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 アゼラスチン塩酸塩… 1mg |
|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、ヒドロキシプロピルセルロース、ステアリン酸マグネシウム、軽質無水ケイ酸、ヒプロメロース、白糖、アラビアゴム末、ポリオキシエチレン(105)ポリオキシプロピレン(5)グリコール、沈降炭酸カルシウム、タルク、酸化チタン、マクロゴール6000、カルナウバロウ |
|---|
製剤の性状
アゼラスチン塩酸塩錠0.5mg「トーワ」
| 剤形 | フィルムコーティング錠 |
|---|
| 色調 | 白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 6.2mm 大きさ(厚さ) 3.0mm |
|---|
| 質量 | 90mg |
|---|
| 識別コード | Tw300 |
|---|
アゼラスチン塩酸塩錠1mg「トーワ」
| 剤形 | 糖衣錠 |
|---|
| 色調 | 白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 6.5mm 大きさ(厚さ) 3.6mm |
|---|
| 質量 | 120mg |
|---|
| 識別コード | Tw RP
Tw.RP |
|---|
効能又は効果
用法及び用量
〈気管支喘息〉
通常、アゼラスチン塩酸塩として1回2mgを、朝食後及び就寝前の1日2回経口投与する。
なお、年齢、症状により適宜増減する。
〈アレルギー性鼻炎及び蕁麻疹、湿疹・皮膚炎、アトピー性皮膚炎、皮膚そう痒症、痒疹〉
通常、アゼラスチン塩酸塩として1回1mgを、朝食後及び就寝前の1日2回経口投与する。
なお、年齢、症状により適宜増減する。
重要な基本的注意
〈効能共通〉
眠気を催すことがあるので、本剤投与中の患者には、自動車の運転等の危険を伴う機械の操作には従事させないように十分注意すること。
長期ステロイド療法を受けている患者で、本剤投与によりステロイド減量をはかる場合は十分な管理下で徐々に行うこと。
〈アレルギー性鼻炎〉
本剤を季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
〈気管支喘息〉
本剤はすでに起こっている発作を速やかに軽減する薬剤ではないので、このことを患者に十分説明しておく必要がある。
特定の背景を有する患者に関する注意
妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で大量投与(臨床用量の370倍以上)による催奇形作用が報告されている。
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中へ移行することが報告されている。
小児等
低出生体重児、新生児、乳児又は幼児を対象とした臨床試験は実施していない。
高齢者
減量するなど注意すること。一般に生理機能が低下している。
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 |
|---|
精神神経系 | 眠気、倦怠感 | めまい、頭痛、手足のしびれ | |
|---|
消化器 | 口渇、悪心・嘔吐 | 口内及び口周囲のあれ、食欲不振、胸やけ、胃部不快感、腹痛、便秘、下痢 | |
|---|
循環器 | | 顔面のほてり、動悸 | |
|---|
呼吸器 | | 鼻乾燥、息苦しさ | |
|---|
肝臓 | | AST、ALTの上昇等 | Al-Pの上昇 |
|---|
過敏症 | | 発疹 | |
|---|
血液 | | | 白血球増多 |
|---|
泌尿器 | | 頻尿 | 排尿困難、血尿 |
|---|
その他 | 苦味感、味覚異常 | 浮腫 | 月経異常 |
|---|
注)発現頻度は製造販売後調査を含む。
適用上の注意
薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜に刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
その他の注意
臨床使用に基づく情報
薬剤自身の味である苦味のため苦味感、味覚異常があらわれることがある。
薬物動態
血中濃度
生物学的同等性試験
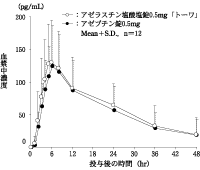
〈アゼラスチン塩酸塩錠0.5mg「トーワ」〉
アゼラスチン塩酸塩錠0.5mg「トーワ」とアゼプチン錠0.5mgを、クロスオーバー法によりそれぞれ1錠(アゼラスチン塩酸塩として0.5mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)~log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。
| 判定パラメータ | 参考パラメータ |
AUC0-48
(pg・hr/mL) | Cmax
(pg/mL) | Tmax
(hr) | T1/2※
(hr) |
アゼラスチン塩酸塩錠
0.5mg「トーワ」 | 2918±1702 | 140.5±65.2 | 5.7±1.2 | 17.62±6.38 |
アゼプチン錠0.5mg | 2660±1586 | 129.1±60.7 | 5.8±0.8 | 16.75±3.75 |
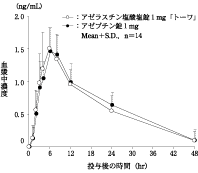
〈アゼラスチン塩酸塩錠1mg「トーワ」〉
アゼラスチン塩酸塩錠1mg「トーワ」とアゼプチン錠1mgを、クロスオーバー法によりそれぞれ3錠(アゼラスチン塩酸塩として3mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された。
注)3mg単回経口投与は承認外用量である。
| 製剤投与量
(アゼラスチン
塩酸塩として) | 判定パラメータ | 参考パラメータ |
AUC0-48
(ng・hr/mL) | Cmax
(ng/mL) | Tmax
(hr) | T1/2
(hr) |
アゼラスチン塩酸塩錠
1mg「トーワ」 | 3錠
(3mg) | 29.25±9.09 | 1.55±0.38 | 5.57±1.16 | 15.04±4.18 |
アゼプチン錠1mg | 3錠
(3mg) | 30.83±8.51 | 1.52±0.35 | 6.36±1.34 | 18.01±12.49 |
有効成分に関する理化学的知見
一般的名称
アゼラスチン塩酸塩(Azelastine Hydrochloride)
化学名
4-[(4-Chlorophenyl)methyl]-2-[(4RS)-
(1-methylazepan-4-yl)]phthalazin-1(2H)-one
monohydrochloride
分子式
C22H24ClN3O・HCl
分子量
418.36
性状
白色の結晶性の粉末である。ギ酸に溶けやすく、水又はエタノール(99.5)に溶けにくい。水溶液(1→200)は旋光性を示さない。
化学構造式
融点
約225℃(分解)
包装
〈アゼラスチン塩酸塩錠0.5mg「トーワ」〉
100錠[10錠×10:PTP]
〈アゼラスチン塩酸塩錠1mg「トーワ」〉
100錠[10錠×10:PTP]
1000錠[10錠×100:PTP]
1000錠[バラ、乾燥剤入り]
主要文献
1
社内資料:生物学的同等性試験(錠0.5mg)
2
社内資料:生物学的同等性試験(錠1mg)
文献請求先及び問い合わせ先
〒570-0081 大阪府守口市日吉町2丁目5番15号
製造販売業者等






 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379