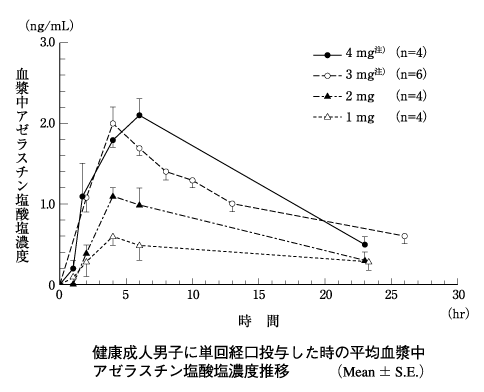
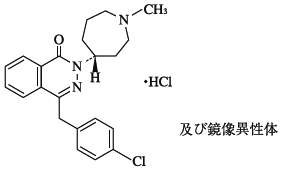
1
牧野荘平ら:臨牀と研究,1985;62(5):1623-1645[AST-0124]
2
奥田 稔ら:耳鼻咽喉科展望,1983;26(S.6):563-605[AST-0102]
3
奥田 稔ら:耳鼻咽喉科展望,1983;26(S.6):606-645[AST-0103]
4
亀田 洋ら:臨牀と研究,1981;58(8):2719-2726[AST-0149]
5
西本正賢:新薬と臨床,1986;35(9):2111-2114[AST-0158]
6
片山 敏ら:Prog. Med.,1986;6(6):1173-1178[AST-0043]
7
松村正典ら:呼吸,1990;9(2):206-212[AST-0267]
8
折笠悦子ら:Prog. Med.,1989;9(8):2272-2279[AST-0262]
9
友岡真樹ら:アレルギー,1988;37(4):213-217[AST-0197]
10
Little, M.M. et al.:J. Allergy Clin. Immunol.,1987;79(1):204[AST-0273]
11
Chand, N. et al.:Eur. J. Pharmacol.,1983;96;227-233[AST-0047]
12
Chand, N. et al.:Int. Arch. Allergy Appl. Immunol.,1985;77:451-455[AST-0274]
13
Yamanaka, T. et al.:Arzneim. Forsch.,1981;31(8):1203-1206[AST-0078]
14
赤木正明ら:応用薬理,1983;26(2):191-197[AST-0067]
15
高橋龍太郎ら:Prog. Med.,1989;9(9):2479-2484[AST-0266]
16
山井孝夫ら:第2回アゼプチン研究会記録集,1989;2(4):12-14[AST-0292]
17
Tasaka, K. et al.:Arzneim. Forsch.,1979;29(3):488-493[AST-0066]
18
Katayama, S. et al.:Arzneim. Forsch.,1981;31(8):1196-1203[AST-0046]
19
Tanigawa, T. et al.:Arzneim. Forsch.,1981;31(8):1212-1215[AST-0063]
20
岩田 勝ら:アレルギー,1989;38(5):428-433[AST-0256]
21
原田 泉ら:耳鼻咽喉科展望,1992;35(S.6):469-474[AST-0403]








 232
232