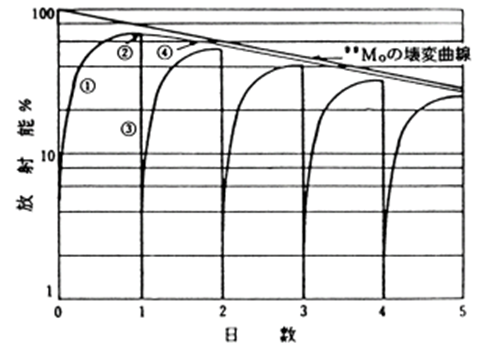
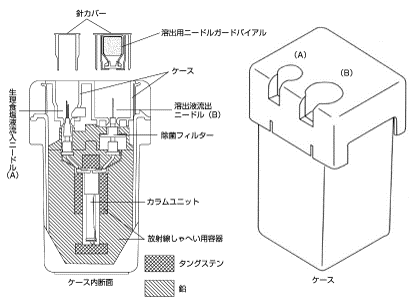
1
Vagenakis AG,et al.:J Nucl Med,1971;12:188
2
McAfee JG,et al.:J Nucl Med,1964;5:811-827
3
Beasley TM,et al.:Health Physics,1966;12:1425-1435
4
MIRD/Dose Estimate Report No.8,J Nucl Med,1976;17:74-77
5
半田肇,他:脳と神経,1969;21:43-51
6
渡辺克司,他:日本医学放射線学会雑誌,1970;30:555-565
7
有光哲雄,他:脳と神経,1975;27:1279-1285
8
久田欣一,編:最新核医学,金原出版,東京,1982;101,158,302,307
9
久田欣一,他編:最新臨床核医学,金原出版,東京,1986;67,121,397,408
10
鳥塚莞爾,編:新核医学,金芳堂,京都,1882;151,181,365
11
久田欣一,他編:最新臨床核医学,金原出版,東京,1986;68
12
第15改正日本薬局方解説書,廣川書店,東京,2006;C-908
13
半田譲二,他:核医学大系6,実業公報社,1976;5