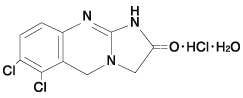
1
Harrison CN, et al.:N Engl J Med. 2005;353(1):33-45.
2
アナグレリドの臨床試験成績①(2014年9月26日承認、CTD 2.7.6.1)
3
アナグレリドの臨床試験成績②(2014年9月26日承認、CTD 2.7.6.24)
4
アナグレリドの臨床試験成績③(2014年9月26日承認、CTD 2.7.2.3)
5
アナグレリドの臨床試験成績④(2014年9月26日承認、CTD 2.7.6.5)
6
アナグレリドの非臨床薬物動態試験成績①(2014年9月26日承認、CTD 2.6.4.4)
7
アナグレリドの非臨床薬物動態試験成績②(2014年9月26日承認、CTD 2.6.4.5)
8
アナグレリドの臨床試験成績⑤(2014年9月26日承認、CTD 2.7.2.2)
9
アナグレリドの臨床試験成績⑥(2014年9月26日承認、CTD 2.7.6.9)
10
アナグレリドの臨床試験成績⑦(2014年9月26日承認、CTD 2.7.6.10)
11
アナグレリドの臨床試験成績⑧(2014年9月26日承認、CTD 2.7.6.11)
12
アナグレリドの臨床試験成績⑨(2014年9月26日承認、CTD 2.7.6.12)
13
アナグレリドの臨床試験成績⑩(2014年9月26日承認、CTD 2.7.6.14)
14
アナグレリドの臨床試験成績⑪(2014年9月26日承認、CTD 2.7.6.13)
15
アナグレリドの臨床試験成績⑫(2014年9月26日承認、CTD 2.7.6.15)
16
アナグレリドの臨床試験成績⑬(2014年9月26日承認、CTD 2.7.6.22)
17
アナグレリドの臨床試験成績⑭(2014年9月26日承認、CTD 2.7.6.23)
18
Ahluwalia M, et al.:J Thromb Haemost. 2010;8(10):2252-2261.