1
社内資料:国内第Ⅰ相試験(薬物動態)(2017年9月27日承認、CTD2.7.2.2)
2
社内資料:国際共同第Ⅱ相試験(EMR100070-003試験)(2017年9月27日承認、CTD2.7.6.2)
3
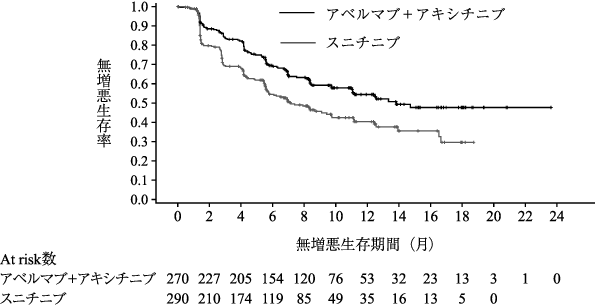
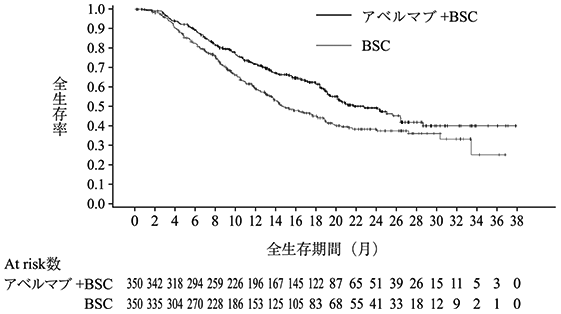
社内資料:国際共同第Ⅲ相試験(B9991003試験)(2019年12月20日承認、CTD2.7.3.3、2.7.6.1)
4
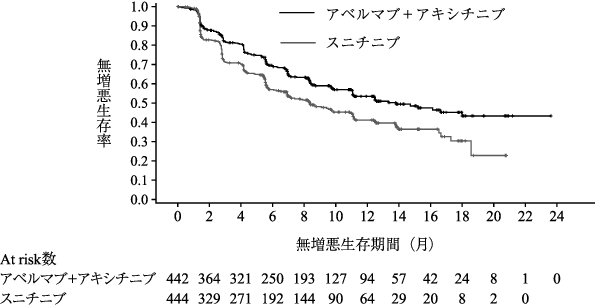
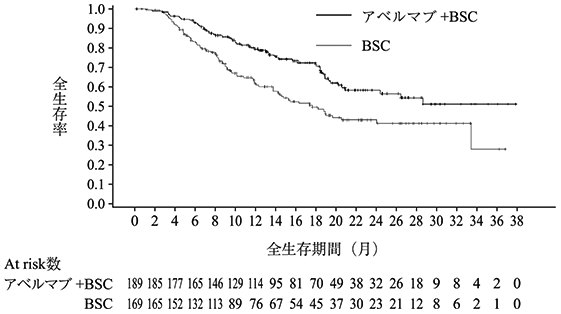
社内資料:国際共同第Ⅲ相試験(B9991001試験)(2021年2月承認、CTD2.7.3.3、2.7.6.1)
5
社内資料:作用機序(2017年9月27日承認、CTD2.6.2.2)