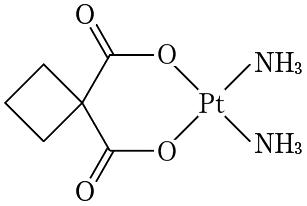
1
Pein F, et al.:J.Clin.Oncol. 1994;12(5):931-936
2
木村禧代二他:Oncologia. 1988;21(4):88-94
3
藤原恵一他:癌と化学療法. 1988;15(6):1943-1948
4
佐々木康綱他:Chemotherapy. 1989;37(3):280-284
5
犬山征夫他:癌と化学療法. 1988;15(7):2131-2138
6
木村禧代二他:癌と化学療法. 1988;15(7):2139-2144
7
小松彦太郎他:癌と化学療法. 1988;15(8):2313-2318
8
Tamura T, et al.:Jpn.J.Clin.Oncol. 1988;18(1):27-32
9
木村禧代二他:癌と化学療法. 1988;15(9):2781-2785
10
新島端夫他:癌と化学療法. 1988;15(8):2305-2311
11
加藤 俊他:癌と化学療法. 1988;15(8):2291-2296
12
野田起一郎他:癌と化学療法. 1988;15(11):3067-3072
13
内藤和行他:癌と化学療法. 1988;15(7):2145-2151
14
犬山征夫他:耳鼻と臨床. 1988;34(6):1511-1519
15
加藤 俊他:癌と化学療法. 1988;15(8):2297-2304
16
Kreisman H, et al.:Cancer Treat. Rep., 1987;71(11):1049-1052
17
Kramer BS, et al.:Am. J. Clin. Oncol., 1988;11(6):643-645
18
Bonomi PD, et al.:J. Clin. Oncol., 1989;7(11):1602-1613
19
Klastersky J, et al.:J. Clin. Oncol., 1990;8(9):1556-1562
20
Belani CP, et al.:Ann. Oncol., 2005;16(7):1069-1075
21
吉谷徳夫他:日本産科婦人科学会雑誌. 1989;41(1):7-14
22
Micetich KC, et al.:Cancer Res., 1985;45(9):4043-4047
23
Knox RJ, et al.:Cancer Res., 1986;46(4):1972-1979
24
Rose WC, et al.:Cancer Treat. Revi., 1985;12(Suppl.A):1-19
25
Rose WC, et al.:Cancer Treat. Rep., 1982;66(1):135-146
26
Lee FH, et al.:Cancer Treat. Revi., 1983;10(1):39-51
27
善積 昇他:Human Cell. 1988;1(3):301-307
28
菊池義公他:癌と化学療法. 1988;15(10):2895-2898