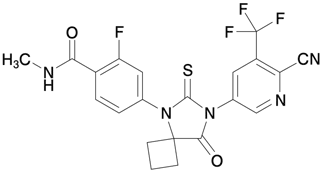
1
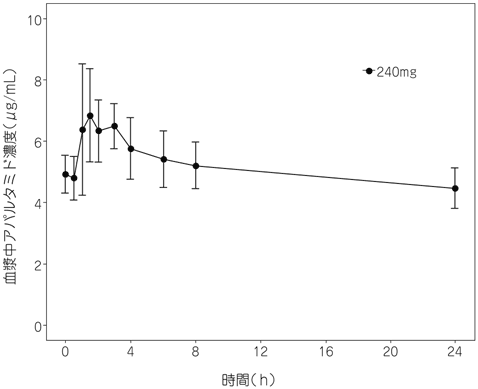
社内資料:アパルタミドの健康成人に対する臨床成績(PCR1021)(2019年3月26日承認、CTD2.7.2.2.1.1)
2
社内資料:アパルタミドの遠隔転移を有する去勢抵抗性前立腺癌患者に対する臨床成績(PCR1008)(2019年3月26日承認、CTD2.7.2.2.1.2)
3
社内資料:アパルタミドの健康成人に対する臨床成績(ARN-509-006)(2019年3月26日承認、CTD2.7.1.2.1.1)
4
社内資料:アパルタミドの健康成人に対する臨床成績(PCR1011)(2019年3月26日承認、CTD2.7.1.2.2.2)
5
社内資料:アパルタミドの血漿蛋白結合率に関する検討(FK10658)(2019年3月26日承認、CTD2.6.4.4.2.1)
6
社内資料:アパルタミドの生理学的薬物動態モデルシミュレーション(FK10644)(2019年3月26日承認、CTD2.7.2.2.3.1)
7
社内資料:アパルタミドの肝機能障害患者に対する臨床成績(PCR1018)(2019年3月26日承認、CTD2.7.2.2.2.1)
8
社内資料:アパルタミドの健康成人を対象とした薬物相互作用試験(PCR1012)(2019年3月26日承認、CTD2.7.2.2.3.1)
9
社内資料:アパルタミドの去勢抵抗性前立腺癌患者を対象とした薬物相互作用試験(PCR1020)(2019年3月26日承認、CTD2.7.2.2.3.2)
10
社内資料:アパルタミドのin vitro薬物相互作用試験(FK10661)(2019年3月26日承認、CTD2.6.4.7)
11
社内資料:アパルタミドのin vitro薬物相互作用試験(FK10651)(2019年3月26日承認、CTD2.6.4.5.4.2)
12
社内資料:アパルタミドのin vitro薬物相互作用試験(FK10660)(2019年3月26日承認、CTD2.6.4.5.4.2)
13
社内資料:アパルタミドのin vitro薬物相互作用試験(301091248)(2019年3月26日承認、CTD2.6.4.5.4.1)
14
社内資料:アパルタミドのin vitro薬物相互作用試験(FK11028)(2019年3月26日承認、CTD2.6.4.7)
15
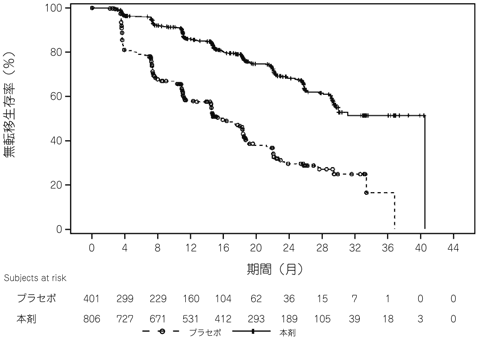
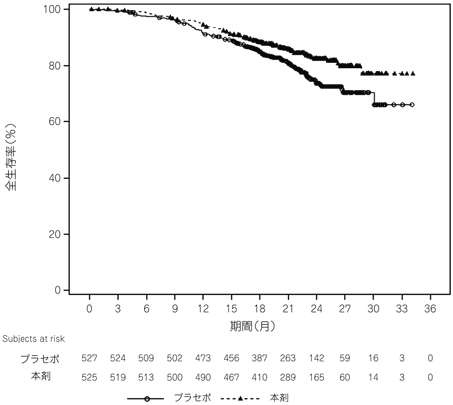
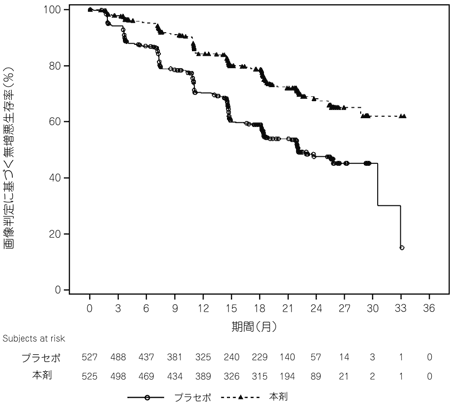
Smith MR, et al.:N Engl J Med. 2018;378:1408-1418
16
社内資料:アパルタミドの遠隔転移を有する前立腺癌患者に対する臨床成績(PCR3002)(2020年5月29日承認、CTD2.7.3.3.2.1)
17
Clegg NJ, et al.:Cancer Res. 2012;72:1494-1503
18
社内資料:アパルタミドの抗腫瘍効果(DR-10-001-PHARM)(2019年3月26日承認、CTD2.6.2.2.8)
19
社内資料:アパルタミドの抗腫瘍効果(DR-10-002-PHARM)(2019年3月26日承認、CTD2.6.2.2.8)
20
社内資料:アパルタミドの抗腫瘍効果(DR-11-004-PHARM)(2019年3月26日承認、CTD2.6.2.2.8)