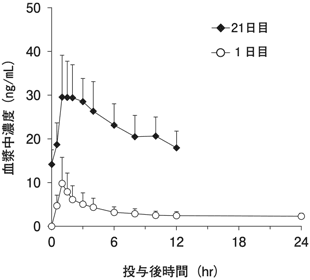
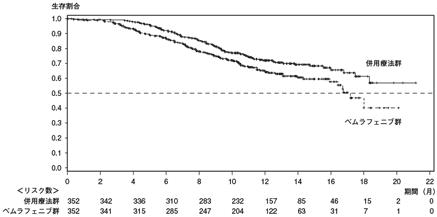
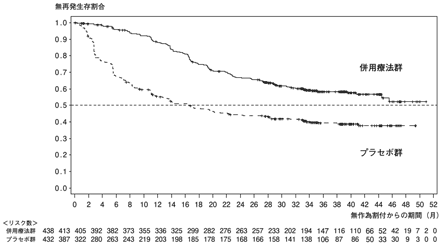
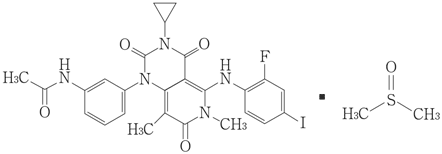
1
社内資料:国内第Ⅰ/Ⅱ相臨床試験(MEK116885試験)(2016年3月28日承認、CTD2.7.6 MEK116885試験)[20160215]
2
Leonowens,C.et al.:Br.J.Clin.Pharmacol. 2014;78(3):524-532[20160223]
3
Cox,D.S.et al. :J.Clin.Pharmacol. 2013;53(9):946-954[20160224]
4
社内資料:In vitro血漿蛋白結合(2016年3月28日承認、CTD2.6.5.6.1)[20160225]
5
社内資料:In vitro血球移行性(2016年3月28日承認、CTD2.6.5.6.3)[20160226]
6
社内資料:In vitro代謝酵素(2016年3月28日承認、CTD2.6.4.5.3.2)[20160227]
7
社内資料:CYP代謝酵素の同定(2016年3月28日承認、CTD2.6.4.5.3)[20160228]
8
Ho,M.Y.K.et al.:Xenobiotica. 2014;44(4):352-368[20160229]
9
社内資料:CYPに対するin vitro代謝阻害(2016年3月28日承認、CTD2.6.4.5.5.2)[20160230]
10
社内資料:CYPに対するin vitro酵素誘導(2016年3月28日承認、CTD2.6.4.5.5)[20160231]
11
社内資料:In vitroトランスポーターの同定(2016年3月28日承認、CTD2.6.4.4.6.3)[20160232]
12
社内資料:In vitroトランスポーター阻害(2016年3月28日承認、CTD2.6.4.4.7.4)[20160233]
13
社内資料:ダブラフェニブとトラメチニブの薬物相互作用(2016年3月28日承認、CTD2.7.2.2.1.3)[20160210]
14
社内資料:海外第Ⅲ相臨床試験(MEK116513試験、COMBI-v)(2016年3月28日承認、CTD2.7.6 MEK116513試験(COMBI-v試験))[20160216]
15
社内資料:海外第Ⅲ相臨床試験(MEK115306試験、COMBI-d)(2016年3月28日承認、CTD2.7.6 MEK115306試験(COMBI-d試験))[20160217]
16
社内資料:国際共同第Ⅲ相臨床試験(F2301試験)(2018年7月2日承認、CTD2.7.6.4.1.1)[20180229]
17
社内資料:国際共同第Ⅱ相臨床試験(E2201試験)(2018年3月23日承認、CTD2.7.6.4.2.1)[20170555]
18
社内資料:国際共同第Ⅱ相臨床試験(X2201試験)(2023年11月24日承認、CTD2.7.6.4.2.1)[20230079]
19
社内資料:海外第Ⅰ/Ⅱ相臨床試験(小児X2101試験)(2023年11月24日承認、CTD2.7.6.4.2.3)[20230078]
20
社内資料:MEK阻害作用(2016年3月28日承認、CTD2.6.2.1.1.1)[20160234]
21
社内資料:マウス異種移植モデルにおける薬理作用(2016年3月28日承認、CTD2.6.2.2.2.1)[20160235]
22
社内資料:BRAF変異陽性ヒト悪性黒色腫由来細胞株の増殖に及ぼす影響(2016年3月28日承認、CTD2.6.2.2.1.5)[20160219]
23
社内資料:BRAF変異陽性ヒト非小細胞肺癌由来細胞株の増殖に及ぼす影響(2018年3月23日承認、CTD2.6.2.2.1.1)[20170556]
24
社内資料:BRAF変異陽性ヒト甲状腺未分化癌由来細胞株の増殖に及ぼす影響(2023年11月24日承認、CTD2.6.2.2.1.1)[20230080]
25
King,A.J.et al.:PLoS One.2013;8(7):e67583[20160221]







 TT
TT


 LL
LL