1
社内資料:非小細胞肺癌患者を対象とした国際共同第I/II相試験(AURA試験)及び国際共同第II相試験(AURA2試験)で認められた体内動態, 2015
2
Vishwanathan K, et al. Clin Pharmacol Drug Dev. 2019;8(2):198-207
3
Vishwanathan K, et al. J Clin Pharmacol. 2018;58(4) 474-484
4
社内資料:オシメルチニブのヒト血漿蛋白結合率, 2016
5
Dickinson PA, et al. Drug Metab Dispos 2016;44(8):1201-1212
6
社内資料:ヒトに[14C]-オシメルチニブを投与したマスバランス試験, 2015(2016年3月28日承認、CTD2.7.2.2.2.1.3)
7
Grande E, et al. J Pharmacol Exp Ther 2019;369(2):291-299
8
Vishwanathan K, et al. Pharmacol Res Perspect. 2020;8(4): e00613. DOI: 10.1002/prp2.613
9
Vishwanathan K, et al. Br J Clin Pharmacol. 2018;84(6):1156-1169
10
Calvo E, et al. J Clin Pharmacol. 2019;59(8):1099-1109
11
Harvey RD, et al. Br J Clin Pharmacol. 2018;84(12):2877-2888
12
社内資料:CYPに対する誘導作用[in vitro試験], 2014(2016年3月28日承認、CTD2.6.4.7.5)
13
社内資料:P-gp及びBCRPの関与[in vitro試験], 2013(2016年3月28日承認、CTD2.6.4.7.6.1)
14
社内資料:血漿中濃度とQT間隔との関連性, 2015(2016年3月28日承認、CTD 2.7.2.3.5.2.3)
15
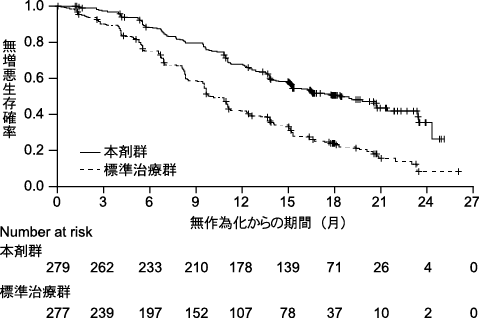
Mok TS, et al. N Engl J Med. 2017;376(7):629-640
16
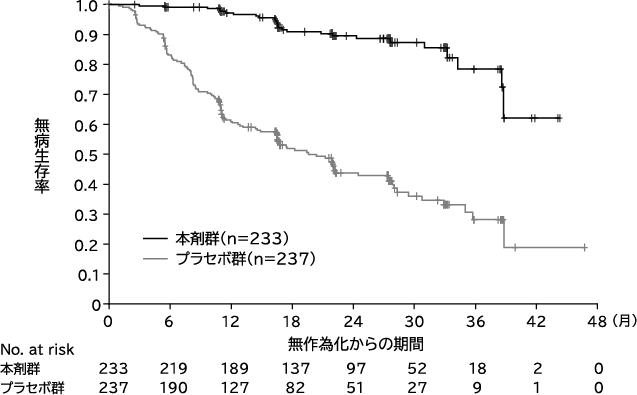
Soria JC, et al. N Engl J Med. 2018;378(2):113-125
17
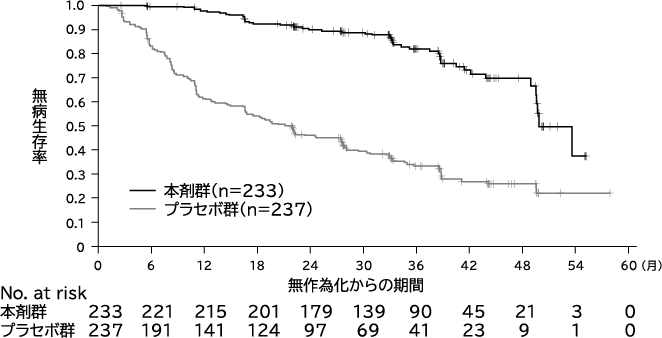
Wu YL, et al. N Engl J Med. 2020;383(18):1711-1723
18
Cross DA, et al. Cancer Discov. 2014;4(9):1046-1061
19
社内資料:In vitroにおける細胞増殖抑制作用, 2014(2016年3月28日承認、CTD2.6.2.2.1.6)
20
社内資料:EGFR依存性腫瘍異種移植モデルにおける抗腫瘍作用, 2013~2014(2016年3月28日承認、CTD2.6.2.2.2.1)
21
社内資料:EGFRm/T790M変異を有するトランスジェニックモデルにおける抗腫瘍作用, 2012(2016年3月28日承認、CTD2.6.2.2.2.5)
22
社内資料:脳転移異種移植モデルにおける抗腫瘍作用, 2014(2016年3月28日承認、CTD2.6.2.2.2.6)
23
Nanjo S, et al. Oncotarget. 2016;7(4):3847-3856