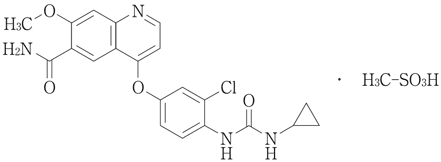
1
NDBを用いた調査結果の概要(VEGF/VEGFR阻害作用を有する薬剤の動脈解離に関するリスク評価):https://www.pmda.go.jp/files/000266521.pdf
2
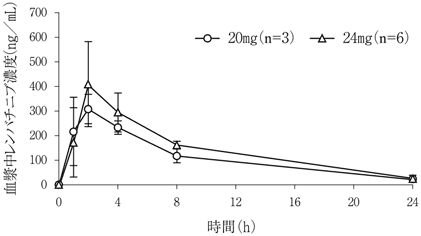
社内資料:固形がん患者を対象とした臨床第Ⅰ相試験(国内試験)(2015年3月26日承認、CTD 2.7.6.6) [LEN-0001]
3
Shumaker R. et al. : Int. J. Clin. Pharmacol. Ther.,2014;52(4):284-291 [LEN-0002]
4
社内資料:血漿蛋白結合率(in vitro)(2015年3月26日承認、CTD 2.6.4.4.2) [LEN-0005]
5
Yamada K. et al. : Clin. Cancer Res.,2011;17(8):2528-2537 [LEN-0006]
6
社内資料:代謝(in vitro及びin vivo)(2015年3月26日承認、CTD 2.7.2.3.2.3) [LEN-0003]
7
社内資料:がん患者を対象としたマスバランス試験(外国試験)(2015年3月26日承認、CTD 2.7.2.2.2.2.1,2.7.6.9) [LEN-0004]
8
社内資料:腎機能障害患者を対象とした臨床薬理試験(外国試験)(2015年3月26日承認、CTD 2.7.2.2.2.3.2) [LEN-0009]
9
社内資料:肝機能障害患者を対象とした臨床薬理試験(外国試験)(2015年3月26日承認、CTD 2.7.2.2.2.3.1) [LEN-0008]
10
社内資料:ケトコナゾールとの薬物相互作用試験(外国試験)(2015年3月26日承認、CTD 2.7.2.2.2.3.3.1) [LEN-0010]
11
社内資料:リファンピシンとの薬物相互作用試験(外国試験)(2015年3月26日承認、CTD 2.7.2.2.2.3.3.2) [LEN-0011]
12
社内資料:トランスポーター(in vitro)(2015年3月26日承認、CTD 2.6.4.8.1) [LEN-0018]
13
社内資料:131Ⅰ難治性の甲状腺分化癌患者を対象とした臨床第Ⅲ相試験(国際共同試験)(2015年3月26日承認、CTD 2.7.6.17) [LEN-0012]
14
社内資料:進行性甲状腺癌患者を対象とした臨床第Ⅱ相試験(国内試験)(2015年3月26日承認、CTD 2.7.6.16) [LEN-0014]
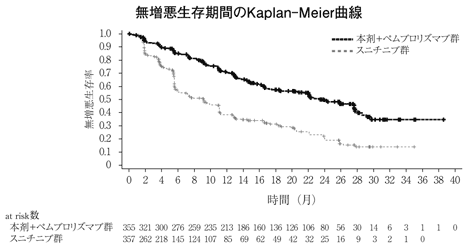
15
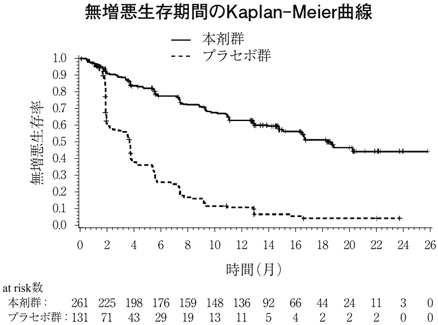
社内資料:切除不能な肝細胞癌患者を対象とした臨床第Ⅲ相試験(国際共同試験)(2018年3月23日承認、CTD 2.7.6.1) [LEN-0168]
16
社内資料:NCCH1508試験(2021年3月23日承認、CTD 2.7.6.1) [LEN-0470]
17
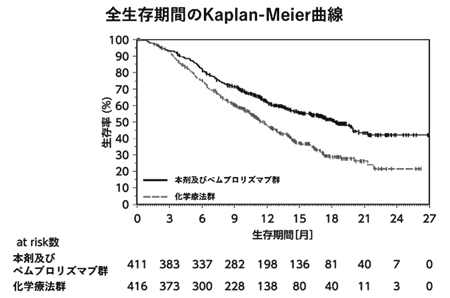
社内資料:進行子宮体癌患者を対象とした臨床第Ⅲ相試験(国際共同試験)(2021年12月24日承認、CTD 2.7.6) [LEN-0653]
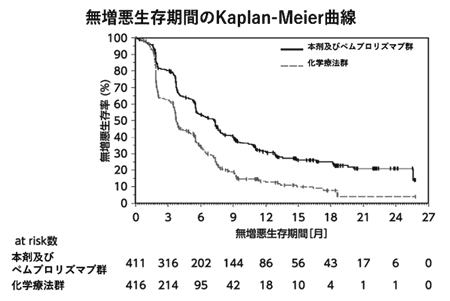
18
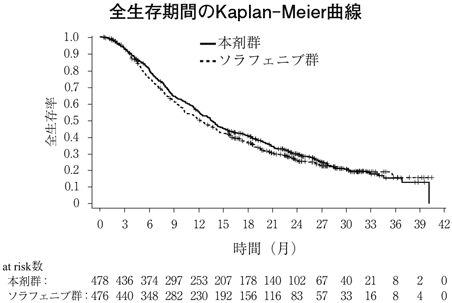
社内資料:根治切除不能又は転移性の腎細胞癌患者を対象とした臨床第Ⅲ相試験(国際共同試験) [LEN-0720]
19
社内資料:In vitro薬理試験(1) (2015年3月26日承認、CTD 2.6.2.2.1) [LEN-0015]
20
社内資料:In vitro薬理試験(2) (2018年3月23日承認、CTD 2.6.2.2.1) [LEN-0169]
21
社内資料:In vivo薬理試験(1) (2015年3月26日承認、CTD 2.6.2.2.2) [LEN-0016]
22
社内資料:In vivo薬理試験(2) (2018年3月23日承認、CTD 2.6.2.2.2) [LEN-0170]
23
社内資料:効力を裏付ける試験(2021年3月23日承認、CTD 2.6.2.2) [LEN-0508]
24
社内資料:In vivo薬理試験(3) [LEN-0721]




 LENV 4mg
LENV 4mg
 LENV 10mg
LENV 10mg