1
RevMate(レナリドミド・ポマリドミド適正管理手順)
2
社内資料:毒性試験の概要文(承認年月日:2015年3月26日、CTD2.6.6.6)
3
社内資料:薬物動態試験の概要文(承認年月日:2015年3月26日、CTD2.6.4.4)
4
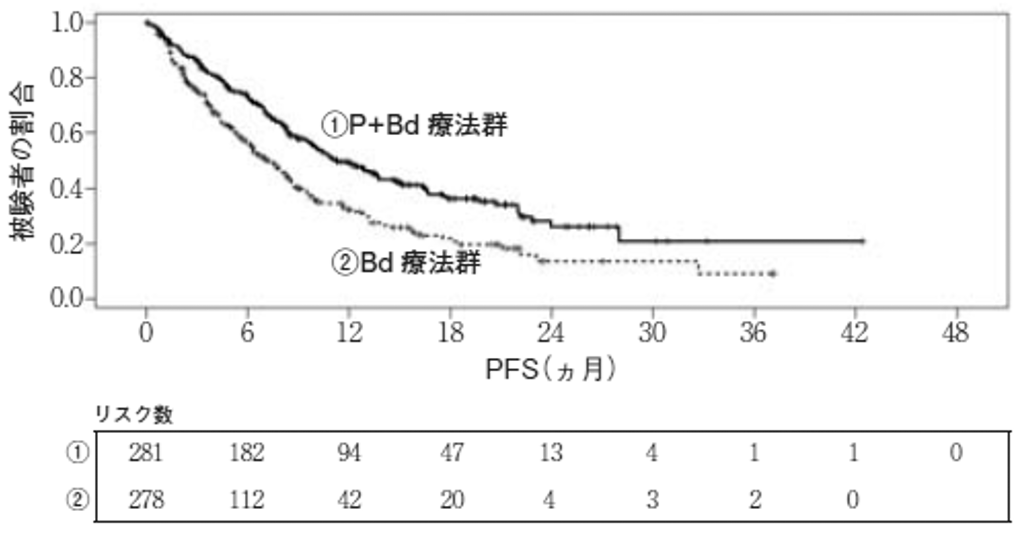
San Miguel JF, et al.:The Lancet Oncology. 2013; 14: 1055-1066.
5
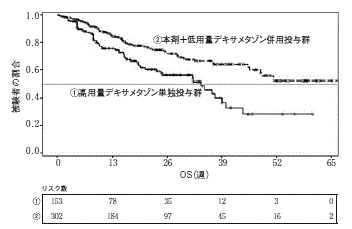
Paul G Richardson, et al.:The Lancet Oncology. 2019; 20(6): 781-794.
6
社内資料:CC-4047-MM-004試験(承認年月日:2015年3月26日、CTD2.7.6.13)
7
社内資料:CC-4047-CP-011試験
8
社内資料:臨床薬理試験(承認年月日:2015年3月26日、CTD2.7.2.3)
9
社内資料:CC-4047-CP-006試験(承認年月日:2015年3月26日、CTD2.7.6.4)
10
Hoffmann M, et al.:Cancer Chemotherapy and Pharmacology. 2013; 71: 489-501.
11
社内資料:CC-4047-CP-004試験(承認年月日:2015年3月26日、CTD2.7.6.5)
12
Yan Li, et al.:Journal of clinical pharmacology. 2017; 9: 133-145.
13
社内資料:CC-4047-CP-009試験
14
Yan Li, et al.:Journal of clinical pharmacology. 2018; 58: 1295-1304.
15
社内資料:CC-4047-CP-008試験(承認年月日:2015年3月26日、CTD2.7.6.6)
16
社内資料:CC-4047-MM-002試験(承認年月日:2015年3月26日、CTD2.7.6.14)
17
社内資料:CC-4047-MM-011試験(承認年月日:2015年3月26日、CTD2.7.6.12)
18
社内資料:CC-4047-MM-003試験(承認年月日:2015年3月26日、CTD2.7.6.11)
19
社内資料:CC-4047-MM-014試験コホートC
20
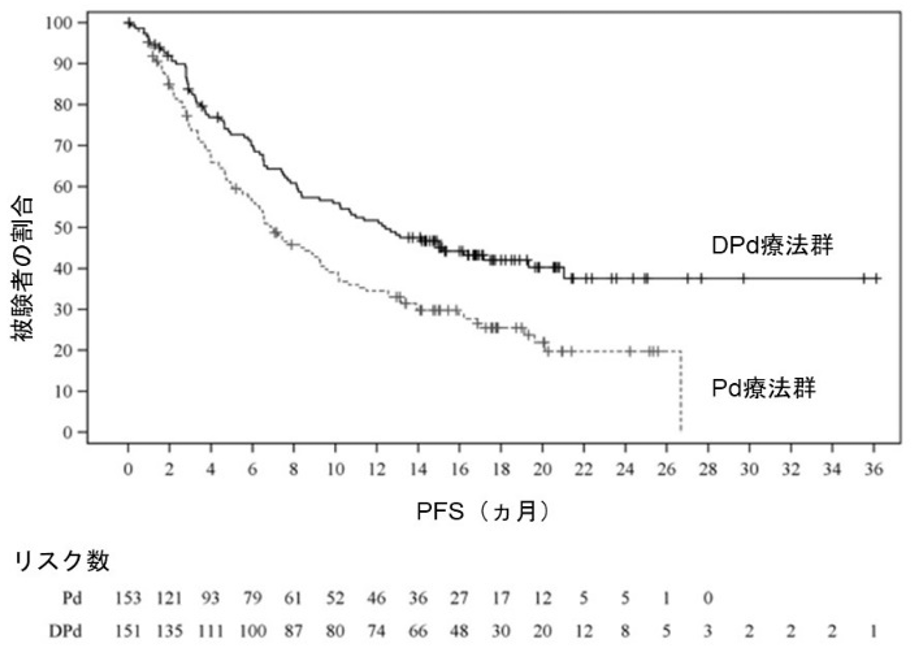
Meletios A Dimopoulos, et al.:The Lancet Oncology. 2021; 22(6): 801-812.
21
社内資料:薬理試験の概要文(承認年月日:2015年3月26日、CTD2.6.2)
22
Lopez-Girona A, et al.:Leukemia. 2012; 26: 2326-2335.