1
社内資料:生殖発生毒性試験(2011年7月1日承認、CTD 2.6.6.6)
2
社内資料:遺伝毒性試験(2011年7月1日承認、CTD 2.6.6.4)
3
Fujiwara Y, et al. Cancer Sci. 2009;100:1728-34.
4
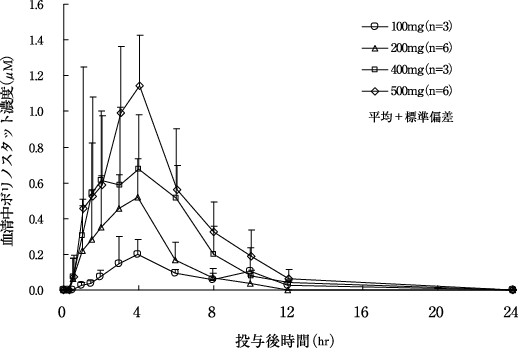
社内資料:国内第Ⅰ相試験(089試験):薬物動態成績(2011年7月1日承認、CTD 2.7.2.2)
5
Rubin EH, et al. Clin Cancer Res. 2006;12:7039-45.
6
社内資料:In vitroにおける血漿蛋白結合(2011年7月1日承認、CTD 2.6.4.4)
7
社内資料:国内第Ⅰ相試験(029試験):薬物動態成績(2011年7月1日承認、CTD 2.7.2.2)
8
社内資料:ヒト試料によるin vitro代謝(2011年7月1日承認、CTD 2.6.4.5)
9
Ramalingam SS, et al. J Clin Oncol. 2010;28:4507-12.
10
Olsen EA, et al. J Clin Oncol. 2007;25:3109-15.
11
社内資料:国内第Ⅰ相試験(089試験):臨床成績(2011年7月1日承認、CTD 2.7.6.2)
12
Duvic M, et al. Blood. 2007;109:31-9.
13
社内資料:ヒストン脱アセチル化酵素阻害作用(2011年7月1日承認、CTD 2.6.2.2)
14
社内資料:ボリノスタットの作用機序(2011年7月1日承認、CTD 2.6.2.2)
15
社内資料:In vitro増殖阻害作用(2011年7月1日承認、CTD 2.6.2.2)
16
社内資料:In vivo有効性試験