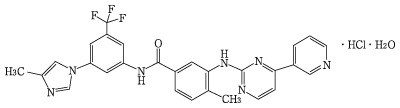
1
社内資料:初発の慢性期CML患者に対する国際共同第Ⅲ相試験 [20106079]
2
社内資料:白血病患者に対する国内第Ⅰ相試験(2009年1月21日承認、CTD2.7.6-4.1.2) [20090203]
3
Tojo,A.et al.:Int.J.Hematol. 2009;89(5):679-688 [20094605]
4
社内資料:外国人における吸収、代謝、排泄試験(2009年1月21日承認、CTD2.7.6-2.1.1) [20090207]
5
Tanaka,C.et al.:Clin.Pharmacol.Ther. 2010;87(2):197-203 [20105902]
6
社内資料:GIST患者における母集団薬物動態解析 [20100066]
7
社内資料:血漿蛋白結合(2009年1月21日承認、CTD2.7.2-3.1.2) [20090209]
8
社内資料:血球移行率(2009年1月21日承認、CTD2.7.2-3.1.2) [20090210]
9
社内資料:代謝酵素の同定(2009年1月21日承認、CTD2.7.2-3.1.3) [20090211]
10
Yin,O.Q.P.et al.:Clin.Ther. 2009;31(Pt2):2459-2469 [20104916]
11
社内資料:小児の白血病患者における薬物動態(2017年12月25日承認、CTD2.7.2-2.1) [20170889]
12
社内資料:イマチニブ抵抗性の慢性期又は移行期CML患者に対する外国第Ⅱ相試験 [20106441]
13
社内資料:小児のCML患者に対する国際共同第Ⅱ相試験(2017年12月25日承認、CTD2.7.6-4.2.1) [20170887]
14
社内資料:Ablキナーゼに対する阻害様式(2009年1月21日承認、CTD2.6.2-2.1) [20090216]
15
Fiskus,W.et al.:Blood 2006;108(2):645-652 [20086118]
16
社内資料:細胞株を用いた測定系による選択的阻害作用(2009年1月21日承認、CTD2.6.2-2.1) [20090213]
17
Manley,P.W.et al.:Biochim.Biophys.Acta 2005;1754(1-2):3-13 [20086119]
18
社内資料:Bcr-Abl変異体に対する自己リン酸化阻害、細胞増殖阻害(2009年1月21日承認、CTD2.6.2-2.2) [20090214]
19
社内資料:BCR-ABL遺伝子導入細胞を静脈内移植したマウスに対する抗腫瘍効果(2009年1月21日承認、CTD2.6.2-2.3) [20090215]