1
DowsettDowsett, M. et al.:Clin. Cancer Res., 1999;5(9):2338-2343
2
閉経後健康女性を対象とした単回及び14日間反復投与試験(フェマーラ錠:2006年1月23日承認、申請資料概要ト. 1. (6) 1))
3
閉経後健康女性を対象とした単回及び14日間反復投与試験(フェマーラ錠:2006年1月23日承認、申請資料概要ヘ. 3. (2) 2))
4
閉経後健康女性を対象とした28日間反復投与試験(フェマーラ錠:2006年1月23日承認、申請資料概要ト. 1. (6) 2))
5
閉経後健康女性を対象とした28日間反復投与試験(フェマーラ錠:2006年1月23日承認、申請資料概要ヘ. 3. (2) 3))
6
一般臨床試験①(フェマーラ錠:2006年1月23日承認、申請資料概要ト. 1. (6) 3))
7
一般臨床試験②(フェマーラ錠:2006年1月23日承認、申請資料概要ヘ. 3. (2) 8))
8
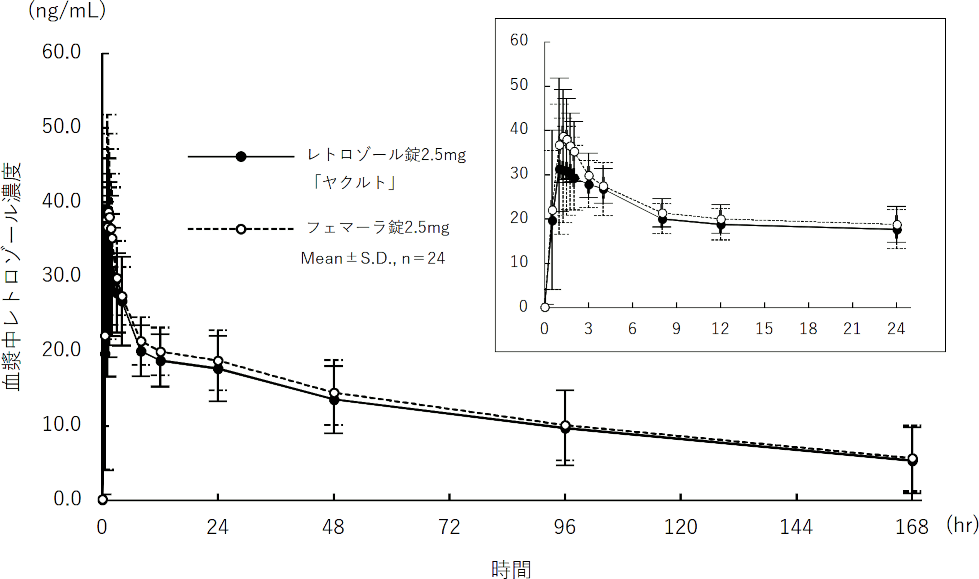
社内資料:生物学的同等性試験
9
Sioufi, A. et al.:Biopharm. Drug Dispos. 1997;18(9):779-789
10
In vitroにおける[14C]レトロゾールのヒト血清蛋白・血球への結合(フェマーラ錠:2006年1月23日承認、申請資料概要ヘ. 2. (2) 4))
11
[14C]レトロゾール単回経口投与時の薬物動態(フェマーラ錠:2006年1月23日承認、申請資料概要ヘ. 3. (1))
12
代謝(フェマーラ錠:2006年1月23日承認、審査報告書)
13
レトロゾール代謝に関与するヒトチトクロームP450分子種の同定(フェマーラ錠:2006年1月23日承認、申請資料概要ヘ. 2. (3) 4))
14
レトロゾールの各CYP分子種に対する阻害活性(フェマーラ錠:2006年1月23日承認、申請資料概要ヘ. 2. (3) 5))
15
肝機能低下の程度の異なる閉経後女性に単回経口投与したときの薬物動態の検討(フェマーラ錠:2006年1月23日承認、申請資料概要ヘ. 3. (5))
16
重度肝機能障害(肝硬変)患者を対象とした単回投与試験(フェマーラ錠:2006年1月23日承認、申請資料概要ヘ. 3. (5))
17
CYP2A6遺伝多型の薬物動態に及ぼす影響(フェマーラ錠:2006年1月23日承認、申請資料概要ヘ. 3. (3))
18
後期第Ⅱ相試験:第2次治療(フェマーラ錠:2006年1月23日承認、申請資料概要ト. 1. (6) 4))
19
Mouridsen, H. et al.:J. Clin. Oncol., 2003;21(11):2101-2109
20
海外第Ⅲ相試験(タモキシフェンとの比較試験:第1次治療)(フェマーラ錠:2006年1月23日承認、申請資料概要ト. 1. (8) 6))
21
The Breast Inernational Group (BIG) 1-98 Collaborative Group:New Engl. J. Med., 2005;353(26):2747-2757
22
海外第Ⅲ相試験(タモキシフェンとの比較試験:術後補助療法(初期治療))(フェマーラ錠:2006年1月23日承認、申請資料概要ト. 1. (8) 8))
23
Goss, P. E. et al.:New Engl. J. Med., 2003;349(19):1793-1802
24
Goss, P. E. et al.:J. Natl. Cancer Instit., 2005;97(17):12162-1271
25
Kar, S.:J. Hum. Reprod. Sci., 2013:6(2):93-98
26
アロマターゼ阻害作用(フェマーラ錠:2006年1月23日承認、審査報告書)
27
Geisler, J. et al.:J. Clin. Oncol., 2002;20(3):751-757
28
in vitroにおける抗腫瘍効果(フェマーラ錠:2006年1月23日承認、審査報告書)
29
ステロイド産生に対する作用(フェマーラ錠:2006年1月23日承認、審査報告書)