1
日本人における薬物動態成績(グリベックカプセル:2001年11月21日承認、申請資料概要へ.3)
2
外国人における薬物動態成績(グリベックカプセル:2001年11月21日承認、申請資料概要へ.3)
3
日本人消化管間質腫瘍患者における薬物動態成績(グリベックカプセル:2003年7月17日承認、申請資料概要へ.1.(1))
4
国内における切除不能・転移性GIST患者に対する第Ⅱ相臨床試験(グリベックカプセル:2003年7月17日承認、申請資料概要ト.1.(2)1))
5
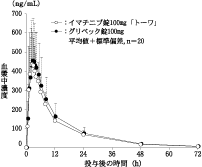
社内資料:生物学的同等性試験(錠100mg)
6
生物学的利用率(グリベックカプセル:2001年11月21日承認、申請資料概要へ.3.(1)1))
7
ヒトにおける薬物動態(グリベックカプセル:2001年11月21日承認、審査報告書)
8
食事の影響(グリベックカプセル:2001年11月21日承認、申請資料概要へ.3.(1)2))
9
血漿蛋白質との結合(蛋白結合率)(グリベックカプセル:2001年11月21日承認、申請資料概要へ.2.(2)4))
10
血漿蛋白質との結合(グリベックカプセル:2001年11月21日承認、申請資料概要へ.2.(2)4))
11
外国人における尿及び糞中累積排泄率(グリベックカプセル:2001年11月21日承認、申請資料概要へ.3.(5))
12
社内資料:生物学的同等性試験(錠200mg)
13
Yanada,M.et al.:J.Clin.Oncol.2006;24(3):460-466
14
チロシンキナーゼ活性、チロシンキナーゼ依存性細胞増殖及び細胞内シグナル伝達に対する作用(グリベックカプセル:2001年11月21日承認、申請資料概要ホ.2)
15
Druker,B.J.et al.:Nat.Med.1996;2(5):561-566
16
PDGF受容体及びc-Kitチロシンキナーゼを介した細胞内シグナル伝達に対する作用(グリベックカプセル:2001年11月21日承認、申請資料概要ホ.2)
17
主代謝物のチロシンキナーゼ活性に対する作用(グリベックカプセル:2001年11月21日承認、申請資料概要ホ.3.(2))
18
Heinrich,M.C.et al.:Blood.2000;96(3):925-932
19
Tuveson,D.A.et al.:Oncogene.2001;20(36):5054-5058
20
bcr-abl遺伝子陽性細胞における細胞増殖抑制作用および抗腫瘍作用(グリベックカプセル:2001年11月21日承認、申請資料概要ホ.1)
21
Carroll,M.et al.:Blood.1997;90(12):4947-4952
22
Deininger,M.W.N.et al.:Blood.1997;90(9):3691-3698
23
le Coutre,P.et al.:J.Natl.Cancer Inst.1999;91(2):163-168
24
Fang,G.et al.:Blood.2000;96(6):2246-2253
25
Oetzel,C.et al.:Clin.Cancer Res.2000;6(5):1958-1968
26
Kasper,B.et al.:Cancer Chemother.Pharmacol.1999;44(5):433-438
27
Verstovsek,S.et al.:Cancer.2005;104(6):1230-1236
28
Kawaguchi,Y.et al.:Leukemia.2001;15(4):590-594









 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379

