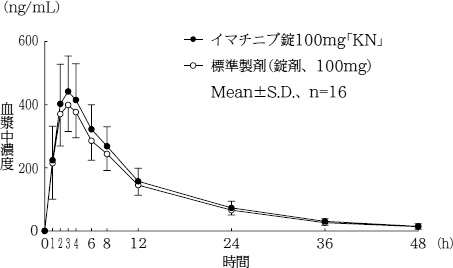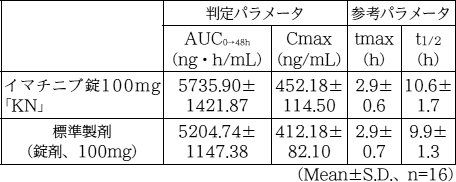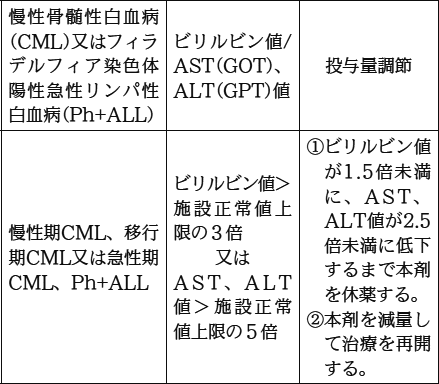
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| ロミタピド (ジャクスタピッド) | ロミタピドの血中濃度が著しく上昇するおそれがある。注 | 本剤のCYP3A4阻害作用により、ロミタピドの代謝が阻害されると考えられる。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| L-アスパラギナーゼ | イマチニブ製剤との併用により肝障害の発現率が上昇したとの報告がある。 | 機序は不明であるが、共に肝障害の副作用を有する。 |
| アゾール系抗真菌剤 エリスロマイシン クラリスロマイシン | 本剤の血中濃度が上昇する可能性がある。 イマチニブ製剤とアゾール系抗真菌剤(ケトコナゾール)の併用により、イマチニブ製剤のCmax及びAUCはそれぞれ26%及び40%増加した。 | これらの薬剤はCYP3A4活性を阻害することにより、本剤の代謝を阻害し、血中濃度を上昇させる可能性がある。 |
| フェニトイン デキサメタゾン カルバマゼピン リファンピシン フェノバルビタール セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品 | 本剤の血中濃度が低下する可能性がある。 フェニトインを長期投与中の患者にイマチニブ製剤を投与した場合、フェニトインを服用していない患者と比べイマチニブ製剤のAUCは約5分の1であった。リファンピシン投与中にイマチニブ製剤を併用投与した場合、単独投与時に比べ、イマチニブ製剤のCmax、AUCがそれぞれ54%及び74%低下した。 | これらの薬剤等はCYP3A4を誘導することにより、本剤の代謝を促進し、血中濃度を低下させる可能性がある。 |
| シンバスタチン シクロスポリン ピモジド トリアゾラム ジヒドロピリジン系カルシウム拮抗剤 | これらの薬剤の血中濃度が上昇することがある。 イマチニブ製剤とシンバスタチンの併用により、シンバスタチンのCmax及びAUCは平均でそれぞれ2及び3倍の増加を示した。また、この相互作用には大きな個体差がみられ、Cmax及びAUCにおける比(併用/単独)の個別値はそれぞれ0.54〜17.6及び0.75〜15.7(最小値〜最大値)の範囲であった。 | 本剤のCYP3A4阻害作用によりCYP3A4基質薬物の代謝を阻害し、血中濃度を上昇させる可能性がある。 |
| ニロチニブ | 本剤及びニロチニブの血中濃度が上昇することがある。 イマチニブ製剤とニロチニブの併用により、イマチニブ製剤のAUCは18〜39%、ニロチニブのAUCは18〜40%上昇したとの報告がある。 | ニロチニブがCYP3A4及びP糖蛋白の活性を阻害して本剤の血中濃度を上昇させる可能性がある。また、本剤がCYP3A4及びP糖蛋白の活性を阻害してニロチニブの血中濃度を上昇させる可能性もある。 |
| ワルファリン | イマチニブ製剤との併用によりプロトロンビン比が顕著に上昇したとの報告がある。抗凝固剤の投与が必要とされる場合は、ヘパリンの投与が望ましい。 | 本剤のCYP2C9阻害作用によりワルファリンの代謝を阻害し、血中濃度を上昇させる可能性がある。 |
| アセトアミノフェン | イマチニブ製剤と高用量のアセトアミノフェン(3〜3.5g/日)との併用により重篤な肝障害が発現したとの報告がある。 | 機序は不明であるが、両薬剤による肝毒性が増強される可能性がある。 |
| グレープフルーツジュース | 本剤の血中濃度が上昇することがある。本剤服用中は飲食を避けること。 | 発現機序の詳細は不明であるが、グレープフルーツジュースに含まれる成分がCYP3A4を阻害することにより、本剤の代謝を阻害し、血中濃度を上昇させる可能性がある。 |