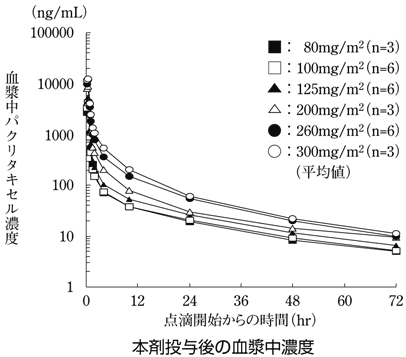
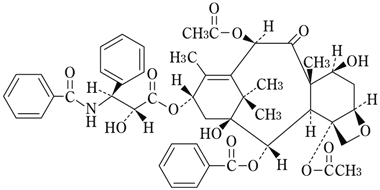
1
臨床第Ⅰ相試験におけるABI-007投与後の薬物動態データを用いた用量比例性の解析(承認年月日:2010年7月23日、CTD2.7.2.2、2.7.2.5)
2
Sparreboom, A., et al. : Clin. Cancer Res. 2005 ; 11(11): 4136-4143
3
Rochat, B. : Clin. Pharmacokinet. 2005 ; 44(4): 349-366
4
A Controlled Randomized, Phase Ⅲ, Multicenter, Open Label Study of ABI-007(A Cremophor-Free, Protein Stabilized, Nanoparticle Paclitaxel)and Taxol in Patients With Metastatic Breast Cancer(承認年月日:2010年7月23日、CTD2.7.2.2、2.7.2.3、2.7.3.2)
5
A Phase I Study To Evaluate The Safety And Pharmacokinetics Of ABI-007 In Patients With Advanced Solid Tumors With Hepatic Dysfunction, 社内資料, 研究報告書No.343
6
Shitara, K., et al. : Lancet Gastroenterol, Hepatol. 2017 ; 2(4): 277-287
7
Sasaki, Y., et al. : Cancer Sci. 2014 ; 105(7): 812-817
8
Bando, H., et al.:Eur. J. Cancer. 2018 ; 91 : 86-91
9
Schmid, P., et al.:N. Engl. J. Med. 2018 ; 379(22): 2108-2121
10
Cortes, J., et al. : Lancet. 2020 ; 396(10265): 1817-1828
11
Socinski, M.A., et al. : J. Clin. Oncol. 2012 ; 30(17): 2055-2062
12
Von Hoff, D.D., et al. : N. Engl. J. Med. 2013 ; 369(18): 1691-1703
13
Schiff, P.B., et al. : Nature. 1979 ; 277(5698): 665-667
14
Schiff, P.B., et al. : Proc. Natl. Acad. Sci. USA. 1980 ; 77(3): 1561-1565
15
Desai, N., et al. : Clin. Cancer Res. 2006 ; 12(4): 1317-1324
16
Awasthi, N., et al. : Carcinogenesis. 2013 ; 34(10): 2361-2369