1
社内資料(Dearlove GE.):ドキシル注の生殖発生毒性試験(2009年4月22日承認、CTD 2.6.6.6-(1))
2
社内資料(Holliday DE.):ドキシル注の生殖発生毒性試験(2009年4月22日承認、CTD 2.6.6.6-(2))
3
社内資料(Kiorpes AL.):ドキシル注の反復投与毒性試験(2009年4月22日承認、CTD 2.6.6.3-(1))
4
社内資料(Sullivan TM.):ドキシル注の反復投与毒性試験(2009年4月22日承認、CTD 2.6.6.3-(2))
5
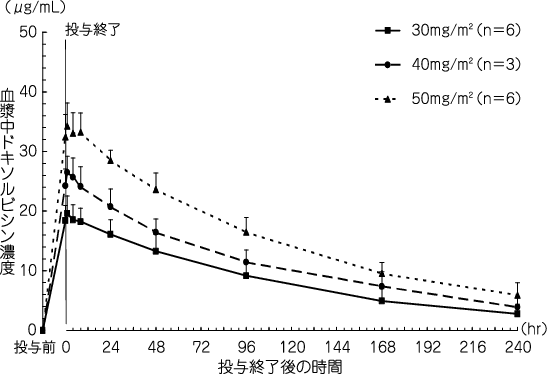
Fujisaka Y, et al.:Jpn J Clin Oncol. 2006, 36, 768-774
6
米国添付文書
7
Katsumata N, et al.:Jpn J Clin Oncol. 2008, 38, 777-785
8
社内資料:ドキシル注のエイズ関連カポジ肉腫患者に対する臨床試験
9
Di Marco A,:Cancer Chemother Rep Part 3. 1975, 6, 91-106
10
根岸嗣治, 他:薬学雑誌, 1973, 93, 1498-1508
11
Potmesil M, et al.:Cancer Res. 1988, 48, 3537-3543
12
社内資料:ドキシル注の卵巣癌異種移植モデルでの増殖抑制作用(2009年4月22日承認、CTD 2.6.2.2(1)-2))
13
Vaage J, et al.:Cancer. 1993, 72, 3671-3675
14
Stürzl M, et al.:Res Virol. 1994, 145, 261-269