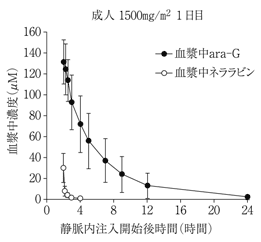
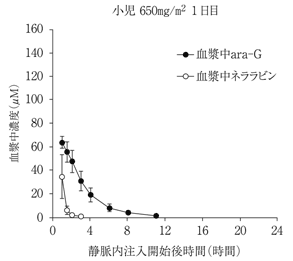
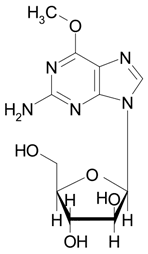
1
Common Terminology Criteria for Adverse Events(National Cancer Institute, https://ctep.cancer.gov/protocoldevelopment/electronic_applications/ctc.htm)
2
堀部敬三ほか:臨床血液.2011;52(6):406-415
3
Lambe,C.U.et al.:Cancer Res.1995;55(15):3352-3356
4
Rodriguez,C.O.Jr.et al.:Cancer Res.1999;59(19):4937-4943