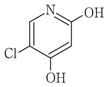
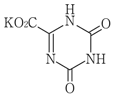
1
Hirata, K. et al.: Clin. Cancer Res. 1999; 5(8): 2000-2005
2
田口鐵男 他: 癌と化学療法. 1997; 24(15): 2253-2264
3
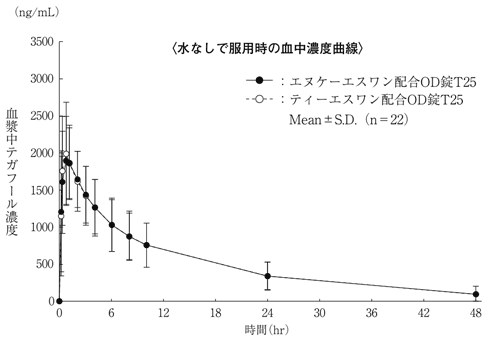
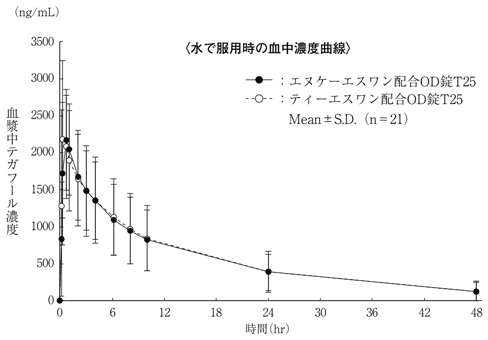
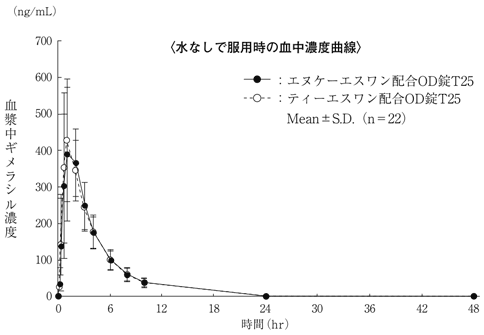
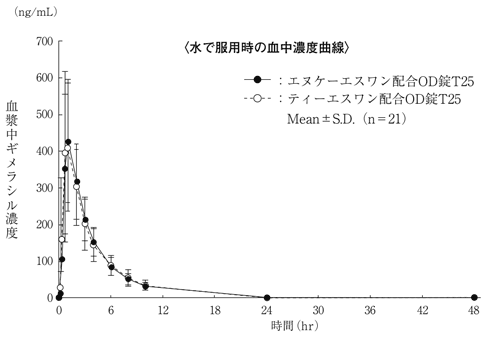
社内資料: 生物学的同等性試験(OD錠T25)
4
増田啓年 他: 薬物動態. 1997; 12(4): 301-321
5
Ikeda, K. et al.: Clin. Cancer Res. 2000; 6(11): 4409-4415
6
S-1の正常及び軽度腎機能低下患者での薬物動態パラメータの比較(ティーエスワンカプセル:2007年8月23日承認、審査報告書)
7
Ikeda, M. et al.: Cancer Chemother. Pharmacol. 2002; 50: 25-32
8
社内資料: 生物学的同等性試験(OD錠T20)
9
Sugimachi, K. et al.: Oncology. 1999; 57(3): 202-210
10
Sakata, Y. et al.: Eur. J. Cancer. 1998; 34(11): 1715-1720
11
Koizumi, W. et al.: Oncology. 2000; 58(3): 191-197
12
Ohtsu, A. et al.: Br. J. Cancer. 2000; 83(2): 141-145
13
Shirao, K. et al.: Cancer. 2004; 100(11): 2355-2361
14
犬山征夫 他: 癌と化学療法. 1998; 25(8): 1151-1158
15
犬山征夫 他: 癌と化学療法. 2001; 28(10): 1381-1390
16
Furuse, K. et al.: Int. J. Clin. Oncol. 2001; 6(5): 236-241
17
Kawahara, M. et al.: Br. J. Cancer. 2001; 85(7): 939-943
18
Ueno, H. et al.: Oncology. 2005; 68(2-3): 171-178
19
Okusaka, T. et al.: Cancer Chemother. Pharmacol. 2008; 61(4): 615-621
20
Ueno, H. et al.: Br. J. Cancer. 2004; 91(10): 1769-1774
21
Furuse, J. et al.: Cancer Chemother. Pharmacol. 2008; 62(5): 849-855
22
国内臨床試験(単独投与)①(ティーエスワン配合カプセル:2020年3月18日公表、再審査報告書)
23
国内臨床試験(単独投与)②(ティーエスワンカプセル:2003年12月17日承認、審査報告書)
24
国内臨床試験(単独投与)③(ティーエスワンカプセル:2004年12月14日承認、審査報告書)
25
国内臨床試験(単独投与)④(ティーエスワンカプセル:2005年11月14日承認、審査報告書)
26
国内臨床試験(単独投与)⑤(ティーエスワンカプセル:2006年8月10日承認、審査報告書)
27
国内臨床試験(単独投与)⑥(ティーエスワンカプセル:2007年8月23日承認、審査報告書)
28
Ichinose, Y. et al.: Clin. Cancer Res. 2004; 10(23): 7860-7864
29
国内第Ⅱ相試験(併用投与)(ティーエスワンカプセル:2004年12月14日承認、審査報告書)
30
Sakuramoto, S. et al.: N. Engl. J. Med. 2007; 357(18): 1810-1820
31
Toi, M. et al.: Lancet Oncol. 2021; 22(1): 74-84
32
Shirasaka, T. et al.: Anti-Cancer Drugs. 1996; 7(5): 548-557
33
Tatsumi, K. et al.: Jpn. J. Cancer Res. 1987; 78(7): 748-755
34
Shirasaka, T. et al.: Cancer Res. 1993; 53(17): 4004-4009
35
Spears, C.P. et al.: Cancer Res. 1984; 44(9): 4144-4150
36
Wilkinson, D.S. et al.: Cancer Res. 1975; 35(11): 3014-3020
37
Takechi, T. et al.: Cancer Chemother. Pharmacol. 1997; 39(3): 205-211
38
Shirasaka, T. et al.: Cancer Res. 1996; 56(11): 2602-2606
39
Fukushima, M. et al.: Int. J. Oncol. 1998; 13: 693-698
40
抗腫瘍効果(ティーエスワンカプセル:2004年12月14日承認、審査報告書)