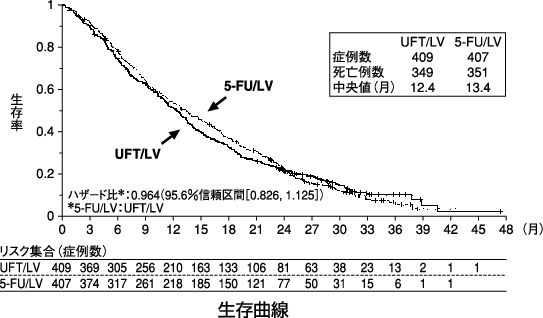
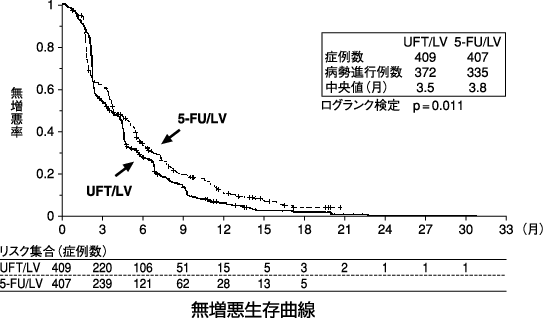
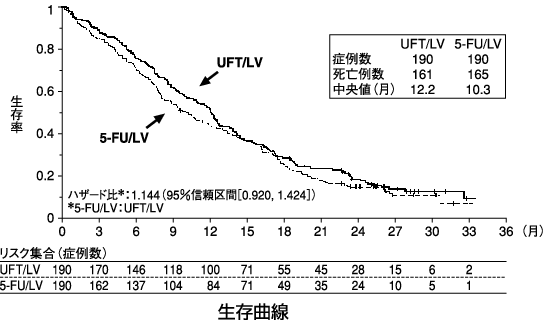
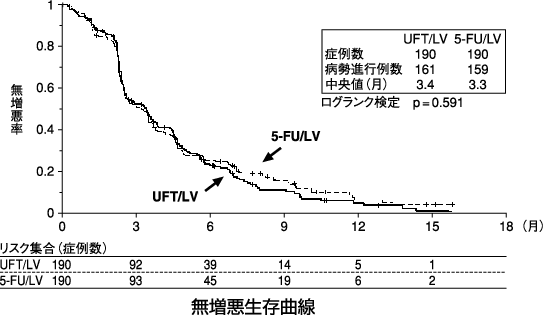
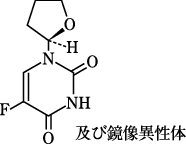
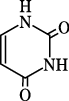
1
高橋達雄 他 : 外科. 1983 ; 45(9): 955-959
2
淺野間光治 他 : 応用薬理. 1981 ; 22(1): 85-107
3
川口安郎 他 : 応用薬理. 1981 ; 21(3): 389-403
4
原富英 他 : 九州神経精神医学. 1992 ; 38(1): 36-41
5
大元謙治 他 : 臨牀消化器内科. 1995 ; 10(5): 705-709
6
向井正哉 他 : 日本癌治療学会誌. 1993 ; 28(6): 942-948
7
長沼睦雄 他 : 臨床神経学. 1988 ; 28(9): 1058-1064
8
河田典子 他 : 心臓. 1990 ; 22(12): 1401-1405
9
中川義久 他 : 呼吸と循環. 1988 ; 36(11): 1265-1268
10
Horio, T. et al. : Arch. Dermatol. 1978 ; 114(10): 1498-1500
11
田中信 他 : 皮膚科の臨床. 1983 ; 25(4): 383-386
12
荒瀬誠治 他 : 皮膚科の臨床. 1987 ; 29(10): 951-957
13
野口勇 他 : ユーエフティ・ユーエフティ細粒の使用成績調査―副作用に関する集計―,社内資料,研究報告書No.52
14
広岡禎 他 : 新薬と臨牀. 1997 ; 46(6): 733-759
15
田口鐵男 他 : 癌と化学療法. 1990 ; 17(7): 1295-1301
16
高橋秀夫 他 : 癌と化学療法. 1990 ; 17(10): 2043-2049
17
菊地金男 他 : 癌と化学療法. 1990 ; 17(11): 2183-2190
18
大山勝 他 : 癌と化学療法. 1990 ; 17(6): 1211-1216
19
都留紀子 他 : 皮膚科の臨床. 1977 ; 19(13): 1157-1166
20
中島修 他 : 癌と化学療法. 1980 ; 7(9): 1558-1568
21
木村禧代二 他 : 癌と化学療法. 1979 ; 6(2): 237-243
22
Kimura, K. et al. : Gastroenterol. Jpn. 1980 ; 15(4): 324-329
23
前田迪郎 他 : 医学のあゆみ. 1981 ; 116(2): 97-100
24
秋谷清 他 : 日本産科婦人科学会雑誌. 1981 ; 33(9): 1328-1335
25
朝日俊彦 他 : 癌と化学療法. 1982 ; 9(3): 503-507
26
末益公人 他 : 癌と化学療法. 1982 ; 9(4): 667-671
27
辻本俊弥 他 : 癌と化学療法. 1983 ; 10(1): 78-83
28
Damle, B. et al. : Clin. Cancer. Res. 2001 ; 7(3): 517-523
29
Ikeda, K. et al. : Clin. Cancer. Res. 2000 ; 6(11): 4409-4415
30
太田和雄 他 : 癌と化学療法. 1987 ; 14(9): 2749-2757
31
志田圭三 他 : 癌と化学療法. 1984 ; 11(6): 1307-1314
32
野代忠宏 他 : 基礎と臨床. 1984 ; 18(7): 3433-3438
33
波多江正紀 他 : 癌と化学療法. 1984 ; 11(11): 2386-2392
34
犬山征夫 他 : 癌と化学療法. 1985 ; 12(3I): 479-484
35
野田起一郎 他 : 癌と化学療法. 1985 ; 12(4): 900-906
36
内藤克輔 他 : 癌と化学療法. 1985 ; 12(7): 1440-1444
37
向井洋 他 : 臨牀と研究. 1985 ; 62(11): 3717-3721
38
田口鐵男 他 : 癌と化学療法. 1987 ; 14(10): 2936-2943
39
二ッ木浩一 他 : 癌と化学療法. 1987 ; 14(5I): 1274-1280
40
Kato, H. et al. : N. Engl. J. Med. 2004 ; 350(17): 1713-1721
41
Shirao, K. et al. : J. Clin. Oncol. 2004 ; 22(17): 3466-3474
42
Douillard, J. -Y. et al. : J. Clin. Oncol. 2002 ; 20(17): 3605-3616
43
Carmichael, J. et al. : J. Clin. Oncol. 2002 ; 20(17): 3617-3627
44
Heidelberger, C. et al. : Cancer Res. 1960 ; 20(6): 903-909
45
Hartmann, K-U. et al. : J. Biol. Chem. 1961 ; 236(11): 3006-3013
46
Heidelberger, C. et al. : Cancer Res. 1963 ; 23(8I): 1226-1243
47
Wilkinson, D. S. et al. : J. Biol. Chem. 1973 ; 248(1): 63-68
48
Wilkinson, D. S. et al. : Cancer Res. 1975 ; 35(11): 3014-3020
49
中村秀次 他 : 癌と化学療法. 1984 ; 11(5): 1049-1055
50
Ikenaka, K. et al. : Gann. 1979 ; 70(3): 353-359
51
Unemi, N. et al. : Chemotherapy. 1981 ; 29(2): 176-184
52
Fujii, S. et al. : Gann. 1978 ; 69(6): 763-772
53
Fujii, S. et al. : Gann. 1979 ; 70(2): 209-214
54
田口鐵男 他 : 癌と化学療法. 1978 ; 5(6): 1161-1165
55
Unemi, N. et al. : Chemotherapy. 1981 ; 29(2): 164-175
56
大山公三 他 : 癌と化学療法. 1982 ; 9(12): 2168-2174
57
藤田昌英 : 癌と化学療法. 1980 ; 7(6): 949-956