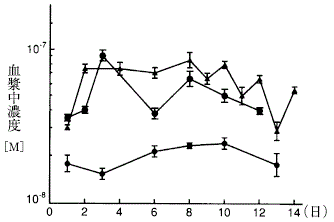
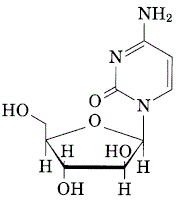
1
Benedict WF, et al.:Science. 1971;171(3972):680-2
2
Kouri RE, et al.:Cancer Res. 1975;35(9):2413-9
3
Ho DHW, et al.:Clin Pharmacol Ther. 1971;12(6):944-54
4
Spriggs D, et al.:Blood. 1985;65(5):1087-9
5
小野泰道ほか:基礎と臨床. 1976;10(12):3268-72
6
天木一太ほか:最新医学. 1970;25(9):1928-37
7
喜多島康一ほか:新薬と臨床. 1969;18(12):1646-52
8
壇 和夫ほか:臨床血液. 1884;25(10):1600-5
9
田嶌政郎ほか:日本臨床. 1986;44(2):388-94
10
椿 和央ほか:癌と化学療法. 1986;13(4):996-1003
11
社内資料:急性白血病に対する臨床成績(承認年月日:1971年3月2日、申請資料概要)
12
中尾 功ほか:癌の臨床. 1972;18(2):138-43
13
太田和雄ほか:日本癌治療学会誌. 1971;6(2):267-76
14
須賀昭二ほか:癌の臨床. 1972;18(3):209-13
15
社内資料:固形癌に対する臨床成績(承認年月日:1973年4月24日、一変申請資料概要)
16
吉田英機ほか:泌尿紀要. 1977;23(1):51-7
17
今村一男ほか:癌と化学療法. 1980;7(7):1244-9
18
加藤廣海ほか:泌尿紀要. 1978;24(7):595-608
19
佐藤 仁ほか:癌と化学療法. 1980;7(7):1250-5
20
社内資料:膀胱腫瘍に対する臨床試験(承認年月日:1984年2月15日、一変申請資料概要)
21
徳永 毅ほか:泌尿紀要. 1980;26(2):229-38
22
Kimball AP, et al.:Proc Soc Exp Biol Med. 1968;127(2):429-32
23
Smets LA, et al.:Cancer Res. 1985;45(7):3113-7
24
Chomienne C, et al.:Semin. Oncol. 1985;12(2 Suppl 3):60-4
25
太田和雄ほか:薬物療法. 1969;2(9):1437-43
26
Evans JS, et al.:Proc Soc Exp Biol Med. 1961;106:350-3
27
社内資料:ラット腹水肝癌に及ぼす影響(承認年月日:1971年3月2日、申請資料概要)
28
田崎 寛ほか:Chemotherapy. 1976;24(8):1597-601
29
星野 章ほか:日化学療会誌. 1970;18(4):384-5
30
星野 章:最新医学. 1973;28(5):844-9
31
星野 章ほか:日血会誌. 1970;33(6/7):781-2
32
宇山 健ほか:西日泌尿. 1977;39(6):916-24
33
Bergerat JP, et al.:Cancer Res. 1981;41(1):25-30