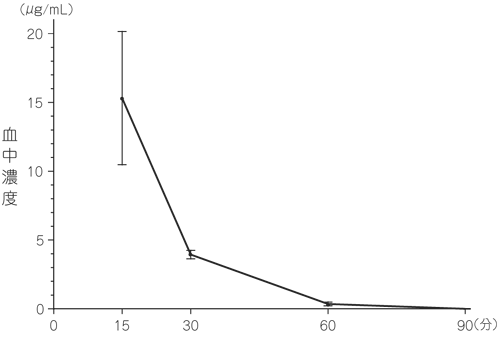
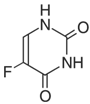
1
菊地金男ほか: 癌と化学療法. 1979; 6: 559-565
2
Christophidis N, et al.: Clinical Pharmacokinetics. 1978; 3: 330-336
3
小池明彦ほか: 癌と化学療法. 1990; 17: 1309-1314
4
Chaudhuri NK, et al.:Biochem Pharmacol. 1959; 1: 328-341
5
菊地金男ほか: 癌の臨床. 1967; 13: 670-676
6
木村禧代二: 癌の臨床. 1968; 14: 184-191
7
坂部孝ほか: 日大医学雑誌. 1970; 29: 352-366
8
古江尚ほか: 癌の臨床. 1970; 16: 896-909
9
田口鐡男ほか: 癌の臨床. 1973; 19: 105-109
10
斉藤達雄ほか: 最新医学. 1973; 28: 903-911
11
三浦健ほか: 癌と化学療法. 1974; 1: 595-613
12
太田和雄ほか: 治療. 1974; 56: 888-894
13
Conroy T, et al.: N Engl J Med. 2011; 364: 1817-1825
14
社内資料: 膵癌FOLFIRINOX法に関する海外臨床試験
15
Hartmann KU, et al.: J Biol Chem. 1961; 236: 3006-3013
16
Spiegelman S, et al.: Cancer. 1980; 45: 1129-1134
17
Goldin A, et al.: Eur J Cancer. 1981; 17: 129-142