1
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:カペシタビン(進行性胃癌)
2
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:カペシタビン(直腸癌における補助化学療法)
3
Cavaliere A,et al. Tumori.1990;76:179-181.
4
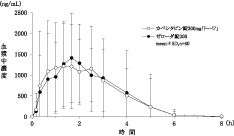
日本人患者における薬物動態(国内前期臨床第Ⅱ相試験)(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.3.2)
5
日本人患者における薬物動態(国内臨床第Ⅰ相試験)(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.3.1)
6
Hyodo I,et al.Jpn J Clin Oncol.2006;36:410-417.
7
進行・転移性の結腸・直腸癌患者を対象とした国内後期第Ⅱ相試験(ゼローダ錠:2007年12月12日承認、審査報告書)
8
社内資料:生物学的同等性試験
9
臓器、組織中濃度(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.2.2.1)
10
胎児移行性(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.2.2.3)
11
カペシタビンの5-FUへの腫瘍選択的変換(ゼローダ錠:2003年4月16日承認、申請資料概要ホ.1.3.2)
12
代謝経路(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.2.3.1)
13
Judson IR,et al.Invest New Drugs.1999;17:49-56.
14
腎機能障害を伴う固形癌患者の薬物動態(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.3.3.7)
15
Camidge R,et al.J Clin Oncol.2005;23:4719-4725.
16
肝ミクロソーム薬物代謝酵素系に対する影響(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.2.3.4)
17
Reigner B,et al.Cancer Chemother Pharmacol.1999;43:309-315.
18
進行・再発乳癌を対象とした前期第Ⅱ相臨床試験(ゼローダ錠:2003年4月16日承認、申請資料概要ト.1.2.1)
19
進行・再発乳癌を対象とした後期第Ⅱ相臨床試験(ゼローダ錠:2003年4月16日承認、申請資料概要ト.1.3.1)
20
ドセタキセル無効の進行・再発乳癌を対象とした後期第Ⅱ相臨床試験(ゼローダ錠:2003年4月16日承認、申請資料概要ト.1.3.2)
21
タキサン系薬剤無効の乳癌を対象とした国内第Ⅱ相試験(ゼローダ錠:2007年12月12日承認、審査報告書)
22
Blum JL,et al.J Clin Oncol.1999;17:485-493.
23
パクリタキセル無効の進行・転移性乳癌に対する第Ⅱ相臨床試験(ゼローダ錠:2003年4月16日承認、申請資料概要ト.3.2.1)
24
パクリタキセル,ドセタキセル無効進行・再発乳癌を対象とした第Ⅱ相臨床試験(ゼローダ錠:2003年4月16日承認、申請資料概要ト.3.2.2)
25
Twelves C,et al.N Engl J Med.2005;352:2696-2704.
26
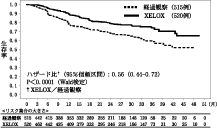
Dukes Cの結腸癌を対象とした術後補助化学療法の海外第Ⅲ相試験(ゼローダ錠:2007年12月12日承認、審査報告書)
27
Schmoll H,et al.J Clin Oncol.2015;33:3733-3740.
28
Schmoll H.J,et al.J CIin Oncol.2007;25:102-109.
29
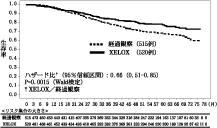
Bang YJ,et al.Lancet.2012;379:315-321.
30
Noh SH,et al.Lancet Oncol.2014;15:1389-1396.
31
作用部位・作用機序(ゼローダ錠:2003年4月16日承認、申請資料概要ホ.1.1.1)
32
Pinedo HM,et al.J Clin Oncol.1988;6:1653-1664.
33
抗腫瘍効果(ゼローダ錠:2003年4月16日承認、申請資料概要ホ.1.4.1)
34
Yanagisawa M,et al.Oncol Rep.2009;22:241-247.
35
Sawada N,et al. Oncol Rep.2007;18:775-778.






 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379

