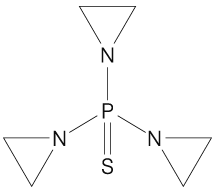
1
Meistrich ML., et al.: Cancer Res. 1982; 42: 122-131
2
Evenson DP., et al.: Toxicol Appl Pharmacol. 1986; 82(1): 151-163
3
大鳥 寛: 日本不妊学会雑誌. 1971; 16(2): 146-148
4
Jackson H., et al.: Br J Pharmacol Chemother. 1959; 14(2): 149-157
5
中村こずえ他: 小児がん. 2009; 46(3): 331-336
6
Waheed F., et al.: Leukemia & Lymphoma. 2004; 45(11): 2253-2259
7
Easton DJ., et al.: Can. Med. Assoc. J. 1983; 129: 578-579
8
IARC: IARC Monographs. 2012; 100A: 163-169
9
Stoner GD.,et al.: Cancer Res. 1973; 33: 3069-3085
10
National Toxicology Program: Natl Cancer Inst Carcinog Tech Rep Ser. 1978; 58: 1-168
11
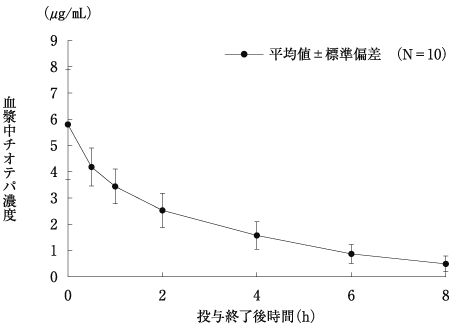
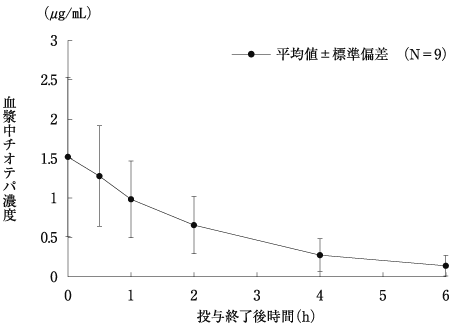
社内資料: チオテパの薬物動態試験(2019年3月26日承認、CTD 2.5.3.1, 2.7.3.3, 2.7.6.1.2.2)
12
Hagen B., et al.: Cancer Chemother Pharmacol. 1987; 20: 319-323
13
Jacobson PA., et al.: Cancer Chemother Pharmacol. 2002; 49: 461-467
14
Maanen MJ., et al.: Cancer Treat Rev. 2000; 26: 257-268
15
Mellett LB., et al.: J Lab Clin Med. 1962; 60: 818-825
16
Hagen B., et al.: Cancer Chemother Pharmacol. 1990; 25: 257–262
17
Veringa SJ., et al.: PLoS One. 2013; 8(4): e61512
18
Huitema AD., et al.: Cancer Chemother Pharmacol. 2000; 46: 119-127
19
Friedman HS., et al.: Cancer Res. 1988; 48: 4189-4195
20
Lünenbürger H., et al.: Anti-Cancer Drugs. 2010; 21: 514-522