作成又は改訂年月
日本標準商品分類番号
薬効分類名
承認等
販売名
ヒアルロン酸ナトリウム関節注25mgシリンジ「日医工」
販売名コード
承認・許可番号
22500AMX00662000
Sodium Hyaluronate
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
室温保存
使用期限:
外箱等に表示の使用期限内に使用すること
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
1シリンジ中
有効成分・含量
精製ヒアルロン酸ナトリウム25mg/2.5mL
1シリンジ中
添加物
塩化ナトリウム21mg,リン酸二水素ナトリウム0.16mg,リン酸水素ナトリウム水和物3.22mg
製剤の性状
| 剤形・性状 | 水性の注射剤
無色澄明な粘稠性のある液 |
|---|
| pH | 6.8〜7.8 |
|---|
| 浸透圧比(生理食塩液に対する比) | 1.0〜1.2
[キット製品] |
|---|
禁忌
効能又は効果
変形性膝関節症,肩関節周囲炎
関節リウマチにおける膝関節痛(下記(1)〜(4)の基準を全て満たす場合に限る)
抗リウマチ薬等による治療で全身の病勢がコントロールできていても膝関節痛のある場合
全身の炎症症状がCRP値として10mg/dL以下の場合
膝関節の症状が軽症から中等症の場合
膝関節のLarsen X線分類がGrade IからGrade IIIの場合
用法及び用量
変形性膝関節症,肩関節周囲炎
通常,成人1回1シリンジを1週間ごとに連続5回膝関節腔内又は肩関節(肩関節腔,肩峰下滑液包又は上腕二頭筋長頭腱腱鞘)内に投与するが,症状により投与回数を適宜増減する。
関節リウマチにおける膝関節痛
通常,成人1回2.5mLを1週間毎に連続5回膝関節腔内に投与する。
本剤は関節内に投与するので,厳重な無菌的操作のもとに行うこと。
使用上の注意
慎重投与
他の薬剤に対して過敏症の既往歴のある患者
肝障害又はその既往歴のある患者[肝障害の既往歴のある患者においてAST(GOT),ALT(GPT)異常値例がみられた。]
投与関節部に皮膚疾患又は感染のある患者[本剤は関節内に投与するため。]
重要な基本的注意
変形性膝関節症,関節リウマチにおける膝関節痛については,投与関節の炎症又は関節液貯留が著しい場合は,本剤の投与により局所炎症症状の悪化を招くことがあるので,炎症症状を抑えてから本剤を投与することが望ましい。
本剤の投与により,ときに局所痛があらわれることがあるので,投与後の局所安静を指示するなどの措置を講じること。
関節腔外に漏れると疼痛を起こすおそれがあるので,関節腔内に確実に投与すること。
関節リウマチにおける膝関節痛については以下の点に注意すること。
本剤による治療は原因療法ではなく局所に対する対症療法であるので抗リウマチ薬等と併用すること。本剤は漫然と連用する薬剤ではない。
抗リウマチ薬等の治療により全身の病勢がコントロールできていても膝関節痛がある場合,当該膝関節腔内に投与すること。
膝関節以外の使用経験はなく,他の関節については有効性・安全性が確立していないため本剤を投与しないこと。
関節リウマチでは膝関節の器質的変化が高度なものは有効性・安全性が確立していないため本剤を投与しないこと。
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
ショック(頻度不明)
ショック症状があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
その他の副作用
以下のような症状が認められた場合は適切な処置を行うこと。
| | 頻度不明 |
| 過敏症注) | 蕁麻疹等の発疹,そう痒感,浮腫(顔面,眼瞼等),顔面発赤 |
| 投与関節 | 疼痛(主に投与後の一過性の疼痛),腫脹,水腫,発赤,熱感,局所の重苦しさ,関節周囲のしびれ感 |
| 肝臓 | AST(GOT)上昇,ALT(GPT)上昇,Al-P上昇,LDH上昇 |
| 血液 | 好酸球増多,ヘマトクリット低下,白血球増多 |
| その他 | 嘔気・嘔吐,発熱,倦怠感,蛋白尿,尿沈渣異常,動悸,ほてり,総蛋白低下,BUN上昇 |
注)発現した場合は投与を中止し,適切な処置を行うこと。
高齢者への投与
一般に高齢者では生理機能が低下しているので注意すること。
妊婦,産婦,授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には,治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[動物実験(ウサギ)では催奇形性は認められていないが,妊娠中の投与に関する安全性は確立していない。]
授乳中の婦人には,本剤投与中は授乳を避けさせること。[動物実験(ラット)で乳汁中へ移行することが認められている。]
小児等への投与
適用上の注意
注射時の注意
本剤は膝関節腔内又は肩関節内に投与するので,厳重な無菌的操作のもとに行うこと。
症状の改善が認められない場合は,5回を限度として投与を中止すること。
関節液の貯留があるときには,必要に応じ穿刺により排液すること。
その他
血管内へは投与しないこと。
眼科用には使用しないこと。
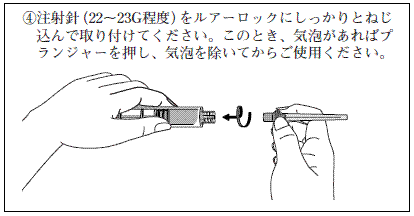
本剤は粘稠なため,22〜23G程度の注射針を用いて投与することが望ましい。
本剤の使用は1回限りとし,開封後は速やかに使用し,使用後は廃棄すること。
本剤は,殺菌消毒剤であるベンザルコニウム塩化物等の第4級アンモニウム塩及びクロルヘキシジンにより沈殿を生じることがあるので十分注意すること。
薬効薬理
関節軟骨表面の被覆・保護作用などにより,疼痛の緩解や関節可動域の改善をもたらす。1)
有効成分に関する理化学的知見
一般名:
精製ヒアルロン酸ナトリウム
(Purified Sodium Hyaluronate)
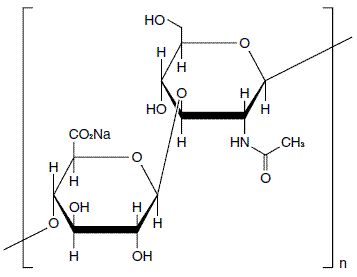
構造式:
分子式:
(C14H20NNaO11) n
分子量:
平均分子量 50万〜149万
性状:
白色の粉末,粒又は繊維状の塊である。
水にやや溶けにくく,エタノール(99.5)にほとんど溶けない。
本品は吸湿性である。
取扱い上の注意
シリンジ包装袋内は滅菌済みのため,使用直前に開封すること。
シリンジ包装袋が開封していたり,破損していた場合には使用しないこと。
安定性試験
本品につき加速試験(40℃,相対湿度75%,6ヵ月)を行った結果,ヒアルロン酸ナトリウム関節注25mgシリンジ「日医工」は通常の市場流通下で3年間安定であることが推測された。2)
包装
主要文献及び文献請求先
主要文献
1
第十七改正日本薬局方解説書 C-4033,廣川書店,東京(2016)
2
日医工株式会社 社内資料:安定性試験
文献請求先
主要文献欄に記載の文献・社内資料は下記にご請求下さい。
日医工株式会社 お客様サポートセンター
〒930-8583 富山市総曲輪1丁目6番21
フリーダイアル(0120)517-215
Fax(076)442-8948
製造販売業者等の氏名又は名称及び住所
製造販売(輸入)元
日医工株式会社
富山市総曲輪1丁目6番21
その他の説明(付属機器の取り扱い等)
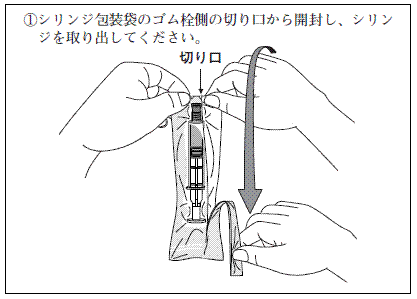
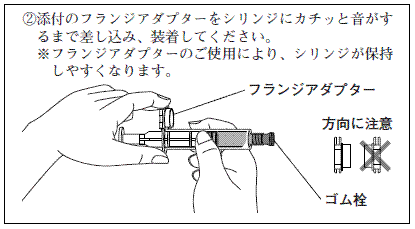
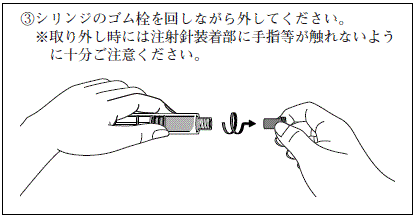
ヒアルロン酸ナトリウム関節注25mgシリンジ「日医工」の使用方法
※投与に先立ち,注射部位を厳重に消毒してください。