1
European Medicines Agency.“Assessment report for calcitonin containing medicinal products”.
2
U.S. Food and Drug Administration.“Background Document for Meeting of Advisory Committee for Reproductive Health Drugs and Drug Safety and Risk Management Advisory Committee”.
3
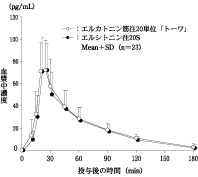
社内資料:生物学的同等性試験
4
藤田 拓男他:医学のあゆみ.1990;152(4):261-282




 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379

