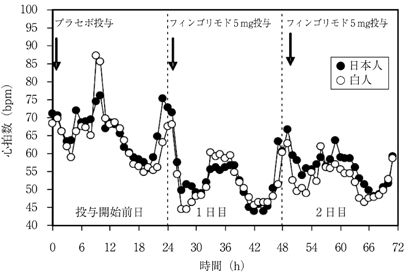
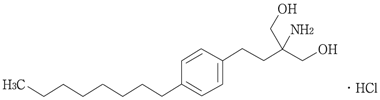
1
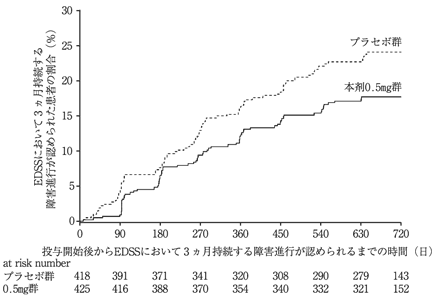
Lublin,F.et al.:Lancet 2016;387(10023):1075-1084 [20160315]
2
社内資料:日本人及び白人健康成人の薬物動態(2011年9月26日承認、CTD2.7.6-3.3.3)[20114629]
3
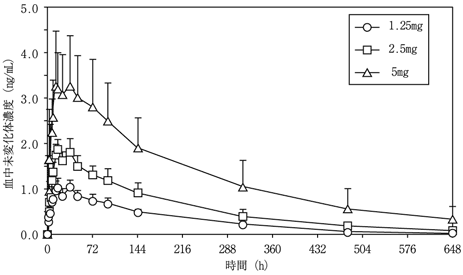
社内資料:日本人多発性硬化症患者での薬物動態(2011年9月26日承認、CTD2.7.6-5.1.1)[20114630]
4
社内資料:食事の影響(2011年9月26日承認、CTD2.7.6-1.1.3)[20114631]
5
社内資料:経口バイオアベイラビリティ(2011年9月26日承認、CTD2.7.6-1.1.2)[20114633]
6
社内資料:In vitro血球移行率及び蛋白結合率(2011年9月26日承認、CTD2.6.4-4.1)[20114634]
7
社内資料:ヒトADME試験(2011年9月26日承認、CTD2.7.6-3.1.2)[20114635]
8
David,O.J.et al.:Int.J.Clin.Pharmacol.Ther.2015; 53(10):847-854 [20160026]
9
Kovarik,J.M.et al.:J.Clin.Pharmacol. 2005; 45(4): 446-452 [20113389]
10
Kovarik,J.M.et al.:J.Clin.Pharmacol. 2006; 46(2) : 149-156 [20113390]
11
Kovarik,J.M.et al.:J.Clin.Pharmacol. 2009; 49(2) : 212-218 [20113392]
12
Kovarik,J.M.et al.:Ann.Pharmacother. 2004; 38(7-8) : 1153-1158 [20113391]
13
社内資料:経口避妊薬との薬物相互作用(2011年9月26日承認、CTD2.7.6-3.4.3)[20114637]
14
Kovarik,J.M.et al.:Br.J.Clin.Pharmacol. 2008; 66(2):199-206 [20113394]
15
Kovarik,J.M.et al.:J.Clin.Pharmacol. 2008; 48(3) : 303-310 [20113395]
16
Kovarik,J.M.et al.:Eur.J.Clin.Pharmacol. 2008; 64(5): 457-463 [20113393]
17
社内資料:カルバマゼピンとの薬物相互作用[20142314]
18
Saida,T.et al.:Mult.Scler. 2012; 18(9) : 1269-1277 [20120868]
19
Kira,J.et al.:BMC Neurol. 2014; 14: 21 [20140786]
20
Kappos,L.et al.:New Engl.J.Med. 2010; 362(5): 387-401 [20110569]
21
社内資料:QT間隔(2011年9月26日承認、CTD2.7.6-4.1.8)[20114641]
22
Brinkmann,V.et al.:Am.J.Transplant. 2004; 4(7): 1019-1025 [20113400]
23
千葉健治:日本臨床免疫学会会誌 2009; 32(2) : 92-101 [20104552]
24
Brinkmann,V.:Br.J.Pharmacol. 2009; 158(5) : 1173-1182 [20113921]
25
Kursar,M.:Eur.J.Immunol. 2008; 38(1): 127-138 [20113922]
26
Choi,J.W.et al.:Proc.Natl.Acad.Sci.USA. 2011; 108(2): 751-756 [20142313]
27
Chiba,K.et al.:Int.Immunopharmacol. 2011; 11(3): 366-372 [20113923]