1
Harris RZ, et al. : Clin Pharmacokinet. 2007; 46: 495-501
2
Nakashima D, et al. : J Clin Pharmacol. 2007; 47: 1311-1319
3
Health Canada Endorsed Important Safety Information on Sensipar® (cinacalcet hydrochloride). June 19, 2007
4
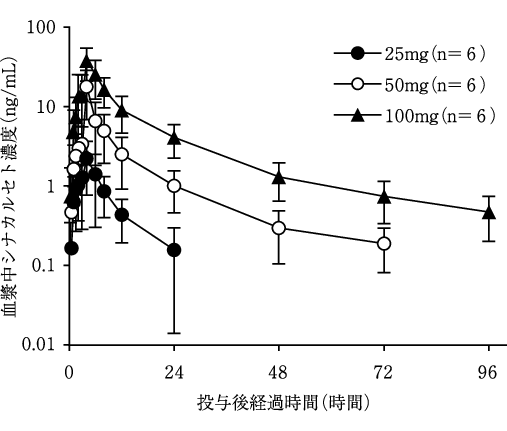
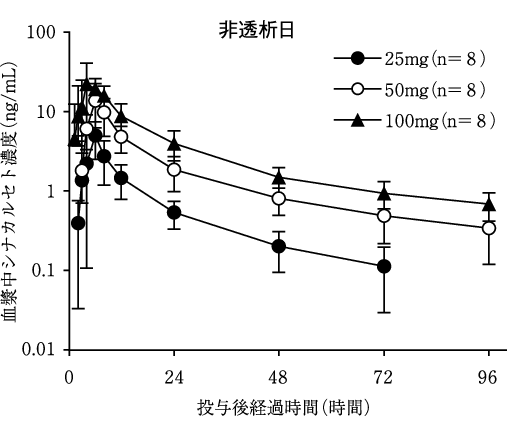
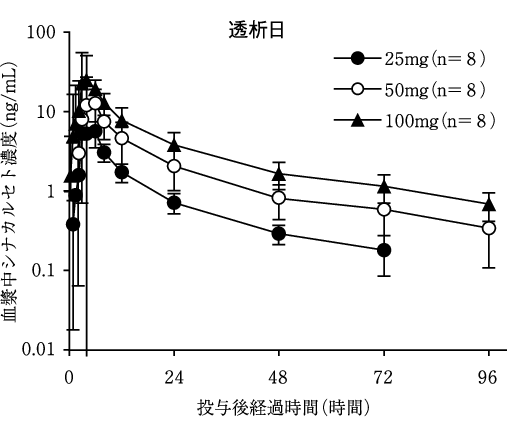
社内資料:健康成人を対象とした本剤の単回経口投与試験(2007年10月19日承認、CTD2.7.2.2.2.1.1)
5
Ohashi N, et al. : Br J Clin Pharmacol. 2004; 57: 726-734
6
社内資料:バイオアベイラビリティ(2007年10月19日承認、CTD2.5.2.1)
7
社内資料:本剤の薬物動態に及ぼす食事の影響に関する検討(2007年10月19日承認、CTD2.7.6.2.1)
8
社内資料:本剤の血漿蛋白結合に関する検討(2007年10月19日承認、CTD2.6.4.4.3.1)
9
Padhi D, et al. : Clin Drug Investig. 2008; 28: 635-643
10
Padhi D, et al. : Clin Pharmacokinet. 2005; 44: 509-516
11
社内資料:本剤の血漿蛋白に対する結合部位の検討(2007年10月19日承認、CTD2.6.4.4.3.2)
12
Kumar GN, et al. : Drug Metab Dispos. 2004; 32: 1491-1500
13
東純一ほか:薬理と治療. 2007;35:953-962
14
社内資料:特別な患者集団における本剤の薬物動態(2007年10月19日承認、CTD2.7.2.3.8)
15
社内資料:本剤の薬物動態に対する炭酸カルシウムの影響に関する検討(2007年10月19日承認、CTD2.7.6.3.9)
16
社内資料:本剤の薬物動態に対するセベラマー塩酸塩の影響に関する検討(2007年10月19日承認、CTD2.7.6.3.10)
17
Fukagawa M, et al. : Nephrol Dial Transplant. 2008; 23: 328-335
18
秋澤忠男ほか:腎と透析. 2007;63:119-131
19
田原英樹ほか:腎と透析. 2007;63:275-288
20
Shigematsu T, et al. : Am J Nephrol. 2009; 29: 230-236
21
窪田実ほか:腎と透析. 2007;63:423-435
22
社内資料:副甲状腺癌及び難治性原発性副甲状腺機能亢進症に伴う高カルシウム血症患者を対象とした本剤の効果(2014年2月21日承認、CTD2.7.6.4)
23
Silverberg SJ, et al. : J Clin Endocrinol Metab. 2007; 92: 3803-3808
24
Marcocci C, et al. : J Clin Endocrinol Metab. 2009; 94: 2766-2772
25
Nemeth EF, et al. : J Pharmacol Exp Ther. 2004; 308: 627-635
26
Kawata T, et al. : J Bone Miner Metab. 2006; 24: 300-306
27
Colloton M, et al. : Kidney Int. 2005; 67: 467-476