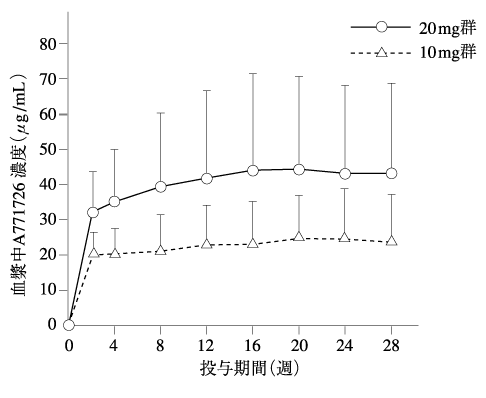
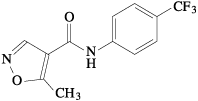
1
百々秀彦 他:新薬と臨牀. 2003;52(7):876-90
2
市川陽一 他:新薬と臨牀. 2003;52(7):891-931
3
社内資料:患者背景因子による血漿中代謝物濃度
4
社内資料:代謝物の安全性及び薬物動態に関する試験(2003年4月16日承認)
5
社内資料:食事の影響(2003年4月16日承認、申請資料概要ヘ.3-1.(3)1))
6
社内資料:動物及びヒトにおける血漿蛋白結合に関する要約(2003年4月16日承認、申請資料概要ヘ.2.(3)1))
7
社内資料:蛋白結合率における相互作用(2003年4月16日承認、申請資料概要ヘ.2.(3)2))
8
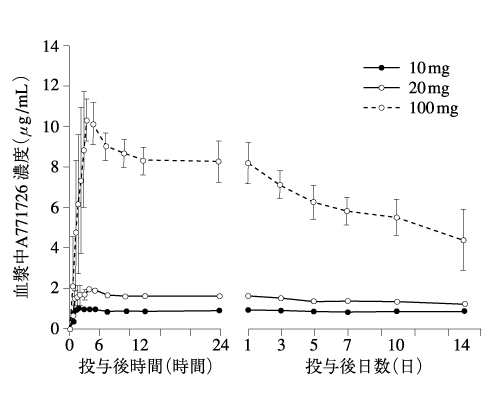
社内資料:健康成人における薬物動態及び代謝(2003年4月16日承認、申請資料概要ヘ.3-1.(1)3))
9
保田国伸 他:新薬と臨牀. 2003;52(7):959-68
10
社内資料:肝機能障害患者における安全性及び薬物動態に関する予備的検討(2003年4月16日承認、申請資料概要ヘ.3-3.2))
11
社内資料:関節リウマチ患者における有効性、安全性及び薬物動態(2003年4月16日承認、申請資料概要ト.II.5.(1))
12
社内資料:リファンピシンとの薬物動態学的相互作用に関する試験(2003年4月16日承認、申請資料概要ヘ.3-2.2))
13
社内資料:低用量経口避妊薬との相互作用(2003年4月16日承認、申請資料概要ヘ.3-2.4))
14
社内資料:in vivoならびにin vitroでの代謝に関する追加試験(2003年4月16日承認、申請資料概要ヘ.2.(4)7))
15
社内資料:代謝に関する研究(2003年4月16日承認、申請資料概要ヘ.2.(4)8))
16
社内資料:薬物動態に対する薬用炭の作用(2003年4月16日承認、申請資料概要ト.I.9.(5)3))
17
社内資料:国内二重盲検用量反応試験(2003年4月16日承認、申請資料概要ト.I.7.(1)2101)
18
Smolen J S, et al.:Lancet. 1999;353(9149):259-66
19
社内資料:第III相二重盲検無作為試験(2003年4月16日承認、申請資料概要ト.I.4.(2)MN301)
20
Strand V, et al.:Arch Intern Med. 1999;159(22):2542-50
21
社内資料:第III相二重盲検無作為試験(2003年4月16日承認、申請資料概要ト.I.4.(1)US301)
22
Williamson R A, et al.:J Biol Chem. 1995;270(38):22467-72
23
Bruneau J-M, et al.:Biochem J. 1998;336:299-303
24
Knecht W, et al.:Biochem Pharmacol. 1998;56(9):1259-64
25
Rückemann K, et al.:J Biol Chem. 1998;273(34):21682-91
26
社内資料:マウスII型コラーゲン誘発関節炎におけるレフルノミドの作用(2003年4月16日承認、申請資料概要ホ.1.(1)1)、ホ.1.(2)1)、ホ.1.(3)1))
27
社内資料:ラットにおける骨破壊に対する効果(2003年4月16日承認、申請資料概要ホ.1.(1)4)、ホ.1.(3)3)-4))
28
社内資料:マウスII型コラーゲン誘発関節炎における抗体産生の亢進に対する作用(2003年4月16日承認、申請資料概要ホ.1.(2)2))
29
社内資料:レフルノミドで治療されたアジュバント関節炎ラットのX線評価(2003年4月16日承認、申請資料概要ホ.1.(3)2))
30
社内資料:ウサギ全骨細胞及び単離破骨細胞を用いたin vitro試験(2003年4月16日承認、申請資料概要ホ.1.(3)5)-6))
31
社内資料:関節リウマチ患者由来滑膜組織を用いたin vitro試験(2003年4月16日承認、申請資料概要ホ.1.(3)8))
32
Kobayashi Y, et al.:J Bone Miner Metab. 2004;22(4):318-28