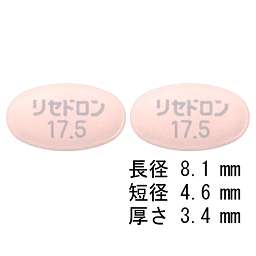
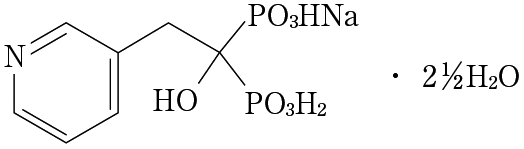
1
Mitchell DY, et al.:Br. J. Clin. Pharmacol. 2000;49:215-222
2
Takata S, et al.: J. Bone Miner. Metab. 2006;24:359-367
3
高田信二郎 他:Osteoporosis Japan. 2007;15:246-249
4
MID-NET®を用いた調査結果の概要(MID-NET®を用いたビスホスホネート製剤の腎機能障害患者における低カルシウム血症のリスク評価に関するデータベース調査):https://www.pmda.go.jp/files/000249186.pdf
5
国内第I相17.5mg単回投与試験(アクトネル錠17.5mg・ベネット錠17.5mg:2007年4月18日承認、申請資料概要2.7.6.1)
6
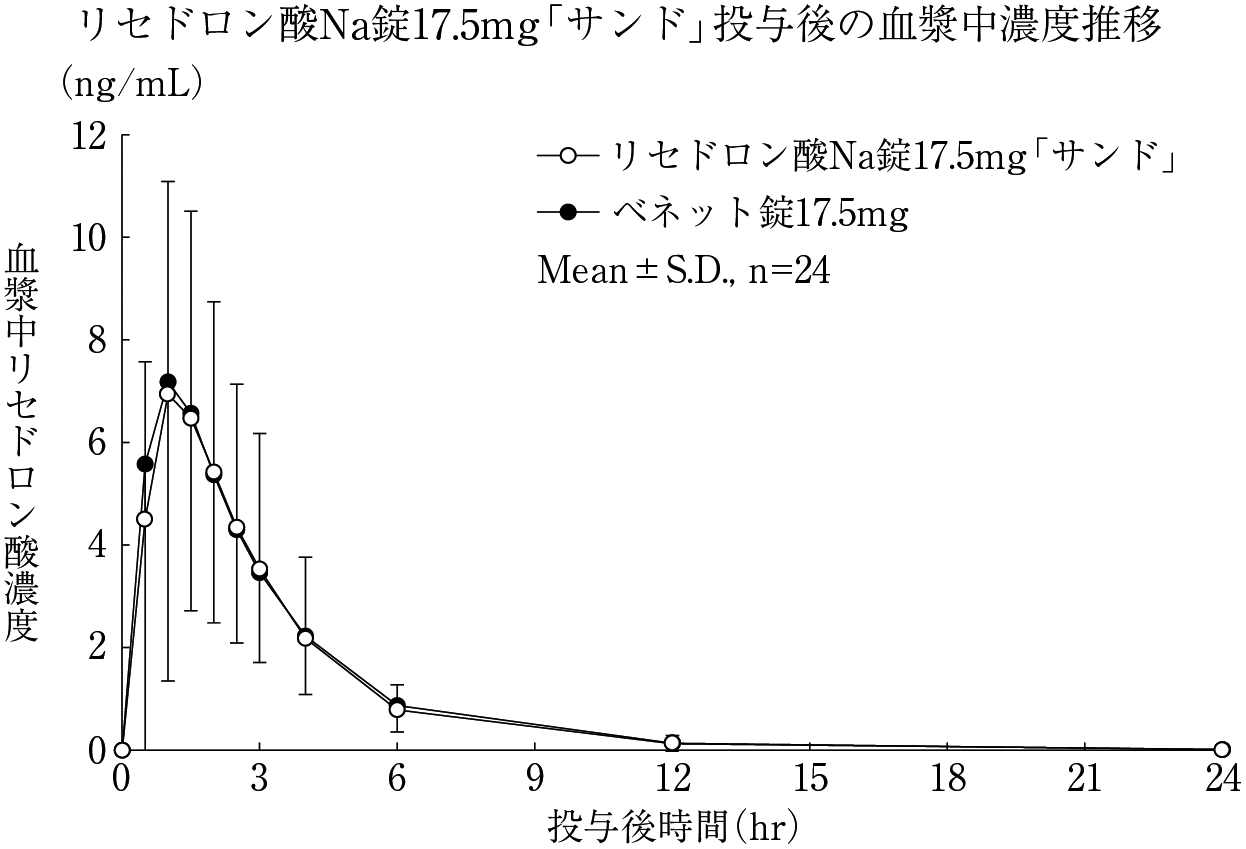
社内資料:生物学的同等性試験(リセドロン酸Na錠17.5mg「サンド」)
7
Ogura Y, et al.:J. Bone Miner. Metab. 2004;22:120-126
8
飲料の影響(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日、審査報告書)
9
腎機能障害患者における体内動態(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要へ.3.(6))
10
Kishimoto H, et al.:J. Bone Miner. Metab. 2006;24:405-413
11
Kushida K, et al.:J. Bone Miner. Metab. 2004;22:469-478
12
個々の試験結果の要約(アクトネル錠17.5mg・ベネット錠17.5mg:2008年7月16日承認、申請資料概要2.7.3.2)
13
有害事象(アクトネル錠17.5mg・ベネット錠17.5mg:2008年7月16日承認、申請資料概要2.7.4.2)
14
Miller PD, et al.:Am. J. Med. 1999;106:513-520
15
海外第III相試験(アクトネル錠17.5mg・ベネット錠17.5mg:2008年7月16日承認、申請資料概要2.7.6.11)
16
作用機序に関する検討(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ホ.1.(6))
17
卵巣摘除モデルに対する作用(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ホ.1.(1).1))
18
Mosekilde LI, et al.:Bone. 2000;27:639-645
19
骨密度と骨強度の相関性に関する検討(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ホ.1.(4).1))
20
骨の石灰化に関する作用(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ホ.1.(4).2))
21
ビーグル犬骨折モデルにおける骨折治癒に対する作用(アクトネル錠2.5mg・ベネット錠2.5mg:2002年1月17日承認、申請資料概要ホ.1.(5))