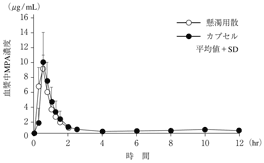
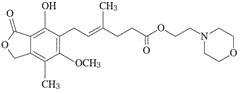
1
Hoeltzenbein M, et al. Am J Med Genet A. 2012;158A:588-96.
2
Coscia LA, et al. Clin Transpl. 2009:103-22.
3
Figueroa J, et al. Transplantation. 1993;55:1371-4.
4
高橋公太, 他. 移植. 1997;32:135-46.
5
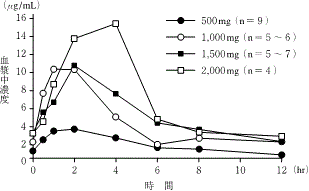
腎移植患者における薬物動態(国内)(1999年9月22日承認、申請資料概要ヘ.3-1-3)
6
社内資料:剤形間の生物学的同等性試験(国内)
7
健康成人における薬物動態(海外)(1999年9月22日承認、申請資料概要ヘ.3-1-1)
8
胆汁中排泄及び腸肝循環(1999年9月22日承認、申請資料概要ヘ.2-4-3)
9
乳汁中移行(1999年9月22日承認、申請資料概要ヘ.2-4-4)
10
飯島一誠, 他. 日本小児腎臓病学会雑誌. 2011;24:36-46.
11
Johnson HJ, et al. Clin Pharmacol Ther. 1998;63:512-8
12
心移植患者における薬物動態(海外)(2003年1月31日承認、申請資料概要ヘ.1-1)
13
肝移植患者における薬物動態(海外)(2003年1月31日承認、申請資料概要ヘ.1-2)
14
打田和治, 他. 移植. 2000;35:29-42.
15
高橋公太, 他. 移植. 2001;36:39-61.
16
Kobashigawa J, et al. Transplantation. 1998;66:507-15.
17
肝移植患者を対象とした第Ⅲ相臨床試験(海外) (2003年1月31日承認、申請資料概要ト.2-1-2)
18
Zuckermann A, et al. J Heart Lung Transplant. 1999;18:432-40.
19
Ross DJ, et al. J Heart Lung Transplant. 1998;17:768-74.
20
Palmer SM, et al. Transplantation. 2001;71:1772-6.
21
Odorico JS, et al. Transplantation. 1998;66:1751-9.
22
Rigotti P, et al. Clin Nephrol. 2000;53:52-4.
23
Merion RM, et al. Transplantation. 2000;70:105-11.
24
Oh JM, et al. J Clin Pharmacol. 2001;41:861-9.
25
Stegall MD, et al. Transplantation. 1997;64:1695-700.
26
Bruce DS, et al. Transplant Proc. 1998;30:1538-40.
27
Gruessner RWG, et al. Transplantation. 1998;66:318-23.
28
Kaufman DB, et al. Transplantation. 1999;67:586-93.
29
Allison AC, et al. Immunol Rev. 1993;136:5-28.
30
Lee HJ, et al. Cancer Res. 1985;45:5512-20.
31
IMPDH, GMPSの特異的抑制作用(1999年9月22日承認、申請資料概要ホ.1-1-2)
32
Eugui EM, et al. Scand J Immunol. 1991;33:161-73.
33
Allison AC, et al. Lancet. 1975;2:1179-83.
34
Grailer A, et al. Transplant Proc. 1991;23:314-5.
35
抗体産生抑制作用(1999年9月22日承認、申請資料概要ホ.1-2-1-4)
36
Eugui EM, et al. Scand J Immunol. 1991;33:175-83.
37
Eugui EM, et al. Transplant Proc. 1991;23 Suppl 2:15-8.
38
Platz KP, et al. Surgery.1991;110:736-41.
39
Morris RE, et al. Transplant Proc. 1990;22:1659-62.
40
Platz KP, et al. Transplantation. 1991;51:27-31.
41
Bechstein WO, et al. Transplant Proc. 1993;25:702-3.
42
Hao L, et al. Transplant Proc. 1990;22:876-9.
43
Morris RE, et al. Transplant Proc. 1991;23 Suppl 2:19-25.
44
Steele DM, et al. Transplant Proc. 1993;25:754-5.
45
Yoshida S, et al. Transplant Proc. 2000;32:2492-3.
46
ラット脈管炎モデルにおける内膜肥厚抑制作用(1999年9月22日承認、申請資料概要ホ.1-2-2-5-3)