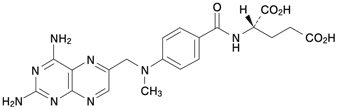
1
厚生労働省:小児薬物療法検討会議報告書:メトトレキサート若年性特発性関節炎.2007:1-15
2
社内資料:副作用発現状況一覧表(再審査終了時) [L70010001741]
3
Kremer J M,et al.:Arthritis Rheum.1986;29(7):832-835
4
Henderson E S,et al.:Cancer Res.1965;25(7):1018-1024
5
Johns D G,et al.:Am J Obstet Gynecol.1972;112(7):978-980
6
柏崎 禎夫ほか:炎症.1996;16(6):437-458
7
四方 義幸ほか:応用薬理.1996;52(6):425-436
8
四方 義幸ほか:応用薬理.1996;52(6):437-442
9
Ridge S C,et al.:J Rheumatol.1986;13(5):895-898
10
Welles W L,et al.:J Rheumatol.1985;12(5):904-906
11
O’Meara A M L,et al.:J Immunopharm.1985;7(2):235-245
12
Rosenthal G J,et al.:Int Immunopharmacol.1987;9(7):793-801
13
Hirata S,et al.:Arthritis Rheum.1989;32(9):1065-1073
14
佐京 かつふみほか:応用薬理.1996;52(6):451-457
15
佐京 かつふみほか:応用薬理.1996;52(6):443-450
16
Cronstein B N,et al.:Proc Natl Acad Sci USA.1991;88(6):2441-2445
17
Sperling R I,et al.:Arthritis Rheum.1992;35(4):376-384
18
Hu S K,et al.:J Rheumatol.1988;15(2):206-209
19
Firestein G S,et al.:Arthritis Rheum.1994;37(2):193-200




 606
606