1
宮本茂敏, 他:現代医療. 1986;18(増Ⅲ):40-50
2
社内資料:生物学的同等性試験[錠50mg]
3
第十八改正日本薬局方解説書. 廣川書店. 2021;C-1003
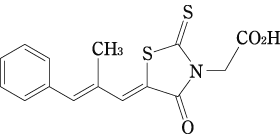
アルドース還元酵素阻害剤
1錠 24.5円
有効成分 | 1錠中、日局エパルレスタット 50mgを含有する。 |
|---|---|
添加剤 | D-マンニトール、ヒドロキシプロピルセルロース、カルメロースカルシウム、ステアリン酸マグネシウム、ヒプロメロース、酸化チタン、カルナウバロウ |
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 白色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 約6.7mm 大きさ(厚さ) 約3.3mm |
| 質量 | 約120mg |
| 識別コード | KW090 |
0.1~0.5%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|
過敏症 | - | 発疹、そう痒、紅斑、水疱等 | - |
肝 臓 | AST・ALT・γ-GTPの上昇等 | ビリルビン上昇 | - |
消化器 | 腹痛、嘔気 | 嘔吐、下痢、食欲不振、腹部膨満感、便秘 | 胸やけ |
腎 臓 | - | BUN上昇、クレアチニン上昇 | 尿量減少、頻尿 |
血 液 | - | 貧血、白血球減少 | - |
その他 | - | 倦怠感、めまい、頭痛、こわばり、脱力感、四肢疼痛、胸部不快感、動悸、浮腫、ほてり | しびれ、脱毛、紫斑、CK上昇、発熱 |
判定パラメータ | 参考パラメータ | |||
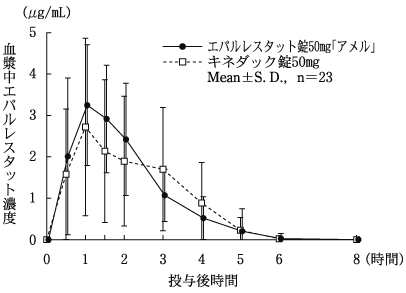
AUC(0→8) (μg・hr/mL) | Cmax (μg/mL) | Tmax (hr) | T1/2 (hr) | |
エパルレスタット錠50mg「アメル」 | 7.74±1.96 | 4.18±1.10 | 1.5±1.1 | 0.7±0.3 |
キネダック錠50mg | 7.49±2.60 | 4.26±1.38 | 1.7±1.1 | 0.7±0.2 |
 0120-041-189
0120-041-189