1
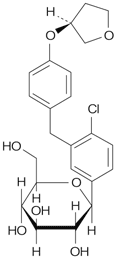
社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.5)
2
社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.5)
3
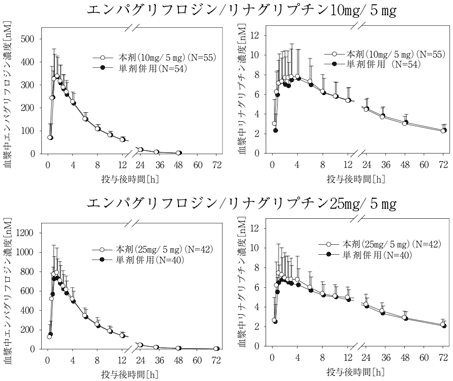
社内資料:エンパグリフロジン/リナグリプチン配合剤の生物学的同等性試験(2018年9月21日承認、CTD 2.7.1.4、2.7.6.1)
4
社内資料:エンパグリフロジン/リナグリプチン配合剤の薬物動態試験(2018年9月21日承認、CTD 2.7.6.1)
5
Retlich S. et al.:Clin Pharmacokinet. 2010;49(12):829-840
6
遅野井 健ほか:Jpn Pharmacol Ther. 2018;46(3):343-353
7
社内資料:日本人2型糖尿病患者を対象としたエンパグリフロジンの腎機能障害試験(2014年12月26日承認、CTD 2.7.6.2)
8
社内資料:エンパグリフロジンのヒトADME試験(2014年12月26日承認、CTD 2.7.6.2)
9
社内資料:リナグリプチン非臨床薬物動態試験(血漿蛋白結合)(2011年7月1日承認、CTD 2.6.4.4)
10
社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.5)
11
社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.5)
12
社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.5)
13
社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.5)
14
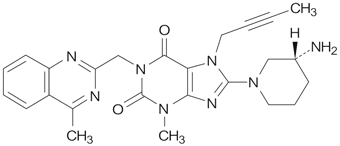
社内資料:リナグリプチン非臨床薬物動態試験(代謝)(2011年7月1日承認、CTD 2.6.4.5)
15
社内資料:リナグリプチン非臨床薬物動態試験(代謝)(2011年7月1日承認、CTD 2.7.2.3)
16
社内資料 リナグリプチン非臨床薬物動態試験(代謝)(2011年7月1日承認、CTD 2.6.4.5)
17
社内資料:健康成人を対象としたリナグリプチンの14C標識体単回投与試験(2011年7月1日承認、CTD 2.7.6.2)
18
Sarashina A. et al.:Drug Metab. Pharmacokinet. 2013;28(3):213-219
19
社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.4)
20
社内資料:エンパグリフロジン非臨床薬物動態試験(トランスポーター)(2014年12月26日承認、CTD 2.6.4.4)
21
社内資料:エンパグリフロジン非臨床薬物動態試験(トランスポーター)(2014年12月26日承認、CTD 2.6.4.4)
22
社内資料:健康成人を対象としたリナグリプチンの単回及び反復投与試験(2011年7月1日承認、CTD 2.7.6.2)
23
社内資料:リナグリプチン非臨床薬物動態試験(トランスポーター)(2011年7月1日承認、CTD 2.6.4.4)
24
Macha S. et al.:Diabetes Obes. Metab. 2014;16(3):215-222
25
Graefe-Mody U. et al.:Diabetes Obes Metab. 2011;13(10):939-946
26
Macha S. et al.:Diabetes Obes. Metab. 2014;16(2):118-123
27
Graefe-Mody U. et al.:Br J Clin Pharmacol. 2012;74(1):75-85
28
社内資料:エンパグリフロジンの2型糖尿病患者母集団薬物動態解析(2014年12月26日承認、CTD 2.7.2.2)
29
社内資料:リナグリプチンの検証試験(2011年7月1日承認、CTD 2.7.6.4)
30
Friedrich C. et al.:Clin. Ther. 2013;35(1):A33-A42
31
Macha S. et al.:Int. J. Clin. Pharmacol. Ther. 2013;51(2):132-140
32
Macha S. et al.:J Diabetes Res. Clin. Metab. 2012;1:14
33
社内資料:エンパグリフロジンとピオグリタゾンとの薬物相互作用試験(2014年12月26日承認、CTD 2.7.6.2)
34
社内資料:エンパグリフロジンとピオグリタゾンとの薬物相互作用試験(2014年12月26日承認、CTD 2.7.6.2)
35
Brand T. et al.:Adv. Ther. 2012;29(10):889-899
36
Macha S. et al.:Diabetes Obes. Metab. 2013;15(4):316-323
37
Macha S. et al.:Clin. Ther. 2013;35(3):226-235
38
社内資料:エンパグリフロジンとシンバスタチンとの薬物相互作用試験(2014年12月26日承認、CTD 2.7.6.2)
39
社内資料:エンパグリフロジンと利尿薬(ヒドロクロロチアジド及びトラセミド)との薬物相互作用試験(2014年12月26日承認、CTD 2.7.6.2)
40
社内資料:エンパグリフロジンとゲムフィブロジルとの薬物相互作用試験(2014年12月26日承認、CTD 2.7.6.2)
41
社内資料:エンパグリフロジンとリファンピシン及びプロベネシドとの薬物相互作用試験(2014年12月26日承認、CTD 2.7.6.2)
42
Macha S. et al.:Clin. Drug. Invest. 2013;33(5):351-357
43
Graefe-Mody EU. et al.:Curr Med Res Opin. 2009;25(8):1963-1972
44
Graefe-Mody EU. et al.:Int J Clin Pharmacol Ther. 2010;48(10):652-661
45
Graefe-Mody U. et al.:Drug Metab Pharmacokinet. 2011;26(2):123-129
46
社内資料:リナグリプチンとリトナビルとの薬物相互作用試験(2011年7月1日承認、CTD 2.7.2.2)
47
社内資料:リナグリプチンとリファンピシンとの薬物相互作用試験(2011年7月1日承認、CTD 2.7.2.2)
48
Graefe-Mody U. et al.:Int J Clin Pharmacol Ther. 2010;48(6):367-374
49
Graefe-Mody EU. et al.:Int J Clin Pharmacol Ther. 2011;49(5):300-310
50
Friedrich C. et al.:Eur J Drug Metab Pharmacokinet. 2011;36(1):17-24
51
Friedrich C. et al.:Clin Drug Investig. 2011;31(9):643-653
52
社内資料:エンパグリフロジン/リナグリプチン配合剤国内第Ⅲ相比較・検証試験(2018年9月21日承認、CTD 2.7.6.3)
53
社内資料:エンパグリフロジン/リナグリプチン配合剤国内第Ⅲ相比較・検証試験(2018年9月21日承認、CTD 2.7.6.3)
54
Gerich JE.:Diabetic Med.:2010;27:136-142
55
社内資料:エンパグリフロジン非臨床薬効薬理試験(in vivo単回)(2014年12月26日承認、CTD 2.6.2.2)
56
Rauch T. et al.:Diabetes Ther. 2012;3(1):10
57
社内資料:非臨床薬効薬理試験(in vivo併用時)(2018年9月21日承認、CTD 2.6.2.2)
58
社内資料:エンパグリフロジン非臨床薬効薬理試験(in vitro)(2014年12月26日承認、CTD 2.6.2.2)
59
社内資料:エンパグリフロジンの日本人2型糖尿病患者を対象とした4週間反復投与試験(2014年12月26日承認、CTD 2.7.6.3)
60
社内資料:エンパグリフロジン非臨床薬効薬理試験(in vivo反復)(2014年12月26日承認、CTD 2.6.2.2)
61
社内資料:エンパグリフロジンの日本人2型糖尿病患者を含む国際共同第Ⅲ相24週投与試験(2014年12月26日承認、CTD 2.7.6.4)
62
社内資料:リナグリプチン非臨床薬効薬理試験(2011年7月1日承認、CTD 2.6.2.2)
63
社内資料:リナグリプチン非臨床薬効薬理試験(2011年7月1日承認、CTD 2.6.2.2)
64
Horie Y. et al.:Clin Ther. 2011;33(7):973-989





 10/5
10/5
 25/5
25/5