1
Tuchmann-Duplessis H, et al.:Compt Rend.1961;253:321-323.
2
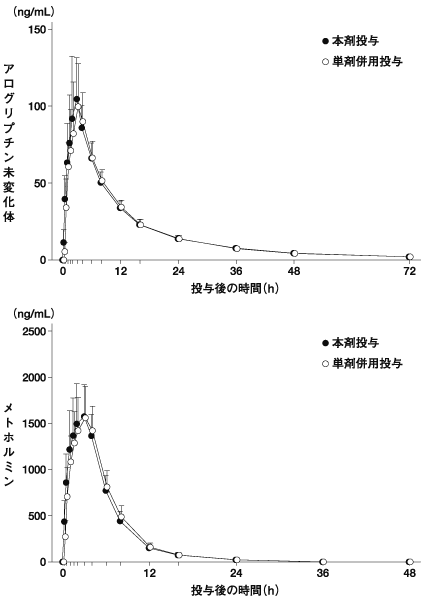
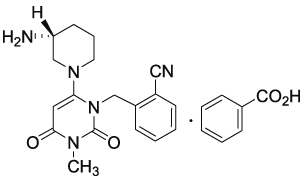
アログリプチン/メトホルミン配合剤の薬物動態試験成績①(2016年9月28日承認:CTD2.7.6.2)
3
アログリプチン/メトホルミン配合剤の薬物動態試験成績②(2016年9月28日承認:CTD2.7.6.1)
4
アログリプチンの蛋白結合に関する検討(2010年4月16日承認:CTD2.7.2.2)
5
アログリプチンの代謝に関する検討①(2010年4月16日承認:CTD2.7.2.1)
6
アログリプチンの代謝に関する検討②(2010年4月16日承認:CTD2.7.2.2)
7
アログリプチンの代謝に関する検討③(2010年4月16日承認:CTD2.7.2.3)
8
Study No.AE-4997-G, Final Report(Takeda Pharmaceutical Company Limited. 社内資料)
9
アログリプチンの腎機能障害患者における薬物動態試験成績(2010年4月16日承認:CTD2.7.6.14)
10
アログリプチンの肝機能障害患者における薬物動態試験成績(2010年4月16日承認:CTD2.7.6.15)
11
アログリプチンの高齢者における薬物動態試験成績(2010年4月16日承認:CTD2.7.6.13)
12
アログリプチン/メトホルミン配合剤とメトホルミンとの薬物相互作用試験成績(2016年9月28日承認:CTD2.7.6.3)
13
アログリプチンとピオグリタゾンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
14
アログリプチンとボグリボースとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.3)
15
アログリプチンとアトルバスタチンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
16
アログリプチンとフルコナゾール、ケトコナゾール又はゲムフィブロジルとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
17
アログリプチンとシクロスポリンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
18
アログリプチンとカフェイン、トルブタミド、デキストロメトルファン、ミダゾラム及びフェキソフェナジンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
19
アログリプチンとワルファリンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
20
アログリプチンとエチニルエストラジオール及びノルエチンドロンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
21
アログリプチンとジゴキシンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.3)
22
アログリプチンとグリベンクラミドとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.6.21)
23
アログリプチンとシメチジンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.3)
24
Somogyi A, et al.:Br J Clin Pharmacol.1987;23:545-551.
25
Song I H, et al.:J Acquir Immune Defic Syndr.2016;72:400-407.
26
Johansson S, et al.:Clin Pharmacokinet.2014;53:837-847.
27
アログリプチン/メトホルミン配合剤の臨床試験成績①(2016年9月28日承認:CTD2.7.6.5)
28
アログリプチン/メトホルミン配合剤の臨床試験成績②(2016年9月28日承認:CTD2.7.6.6)
29
アログリプチン/メトホルミン配合剤の臨床試験成績③(2016年9月28日承認:CTD2.7.6.4)
30
アログリプチンの耐糖能改善作用に関する検討①(2010年4月16日承認:CTD2.4.2)
31
アログリプチンの耐糖能改善作用に関する検討②(2010年4月16日承認:CTD2.6.2)
32
Lee A J.:Pharmacotherapy.1996;16:327-351.
33
アログリプチンの酵素阻害活性に関する検討(2010年4月16日承認:CTD2.6.2.1)
34
アログリプチンの薬物動態試験成績①(2010年4月16日承認:CTD2.7.6.6)
35
アログリプチンの薬物動態試験成績②(2010年4月16日承認:CTD2.7.6.27)
36
アログリプチンの耐糖能改善作用に関する検討③(2010年4月16日承認:CTD2.6.2.2)
37
Proske G, et al.:Arzneimittel-Forsch.1962;12:314-318.
38
Opitz K, et al.:Deut Med Wochenschr.1962;87:105-106.
39
Sterne J.:Thérapie.1958;13:650-659.
40
小澤光 他:日薬理誌.1971;67:12-13.
41
Kroneberg G, et al.:Arzneimittel-Forsch.1958;8:470-475.






 317
317