1
Morseth S.L.et al.:薬理と治療.1991;19(11):4325-4340.[文献参照番号][13724]
2
Morseth S.L.et al.:薬理と治療.1991;19(11):4375-4396.[文献参照番号][13727]
3
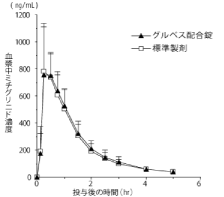
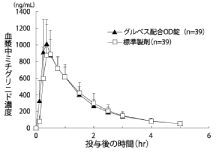
社内資料:健康成人を対象とした生物学的同等性試験(2011年4月22日承認;グルベス配合錠,CTD 2.7.1.2)[文献参照番号][14811]
4
平賀興吾:基礎と臨床.1992;26(1):283-294.[文献参照番号][13703]
5
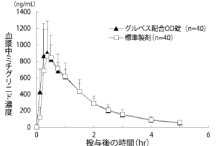
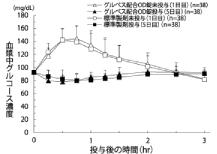
社内資料:健康成人を対象とした生物学的同等性試験(口腔内崩壊錠)[文献参照番号][000182]
6
社内資料:健康成人を対象とした第I相臨床試験(2004年1月29日承認;ミチグリニドカルシウム水和物,申請資料概要 ヘ.3.1.2)[文献参照番号][44005]
7
社内資料:ミチグリニドの血漿蛋白結合率(2004年1月29日承認;ミチグリニドカルシウム水和物,申請資料概要 ヘ.2.2.5)[文献参照番号][70169]
8
前芝良宏ほか:薬理と治療.1991;19(9):3639-3649.[文献参照番号][13717]
9
社内資料:健康成人を対象とした臨床薬理試験(2004年1月29日承認;ミチグリニドカルシウム水和物,申請資料概要 ヘ.3.1.2)[文献参照番号][44004]
10
社内資料:健康成人を対象とした海外臨床薬理試験(2004年1月29日承認;ミチグリニドカルシウム水和物,申請資料概要 ヘ.3.5.2)[代謝物の検討][文献参照番号][44007]
11
社内資料:ミチグリニド代謝に関与するUGT分子種(2004年1月29日承認;ミチグリニドカルシウム水和物,申請資料概要 ヘ.2.3.3)[文献参照番号][44009]
12
社内資料:ミチグリニド代謝に関与するチトクロームP450分子種(2004年1月29日承認;ミチグリニドカルシウム水和物,申請資料概要 ヘ.2.3.4)[文献参照番号][44010]
13
社内資料:健康成人を対象とした海外臨床薬理試験(2004年1月29日承認;ミチグリニドカルシウム水和物,申請資料概要 ヘ.3.5.2)[薬物動態と排泄の検討][文献参照番号][44008]
14
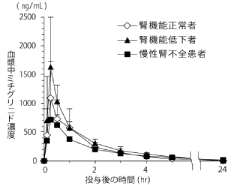
社内資料:腎機能低下者を対象とした臨床薬理試験(2004年1月29日承認;ミチグリニドカルシウム水和物,申請資料概要 ヘ.3.3.2)[文献参照番号][44006]
15
陶易王ほか:薬理と治療.2007;35(suppl.1):39-49.[文献参照番号][56841]
16
加来浩平ほか:薬理と治療.2007;35(suppl.1):51-72.[文献参照番号][56842]
17
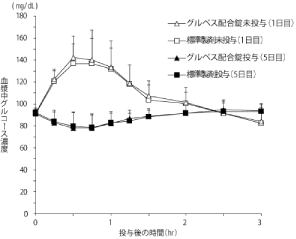
社内資料:2型糖尿病患者を対象とした長期併用投与試験(ボグリボース)[文献参照番号][000165]
18
Ohnota,H.et al.:J.Pharmacol.Exp.Ther. 1994;269(2):489-495.[文献参照番号][22539]
19
Ichikawa,K.et al.:Arzneim.-Forsch./Drug Res. 2002;52(8):605-609.[文献参照番号][39444]
20
Sunaga,Y.et al.:Eur.J.Pharmacol. 2001;431(1):119-125.[文献参照番号][36017]
21
小高裕之ほか:日本栄養・食糧学会誌.1992;45(1):27-31.[文献参照番号][13696]
22
社内資料:ニコチンアミド前処置ストレプトゾトシン誘発2型糖尿病ラットにおける薬効薬理試験(2004年1月29日承認;ミチグリニドカルシウム水和物,申請資料概要 ホ.1.4.3)[文献参照番号][70170]