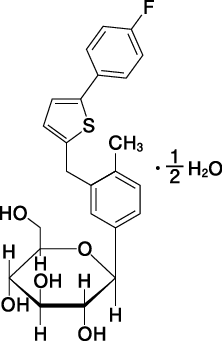
1
Neal B, et al.:N Engl J Med. 2017;377(7):644-657
2
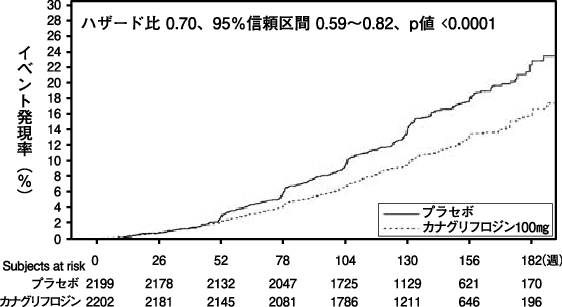
Perkovic V, et al.:N Engl J Med. 2019;380(24):2295-2306
3
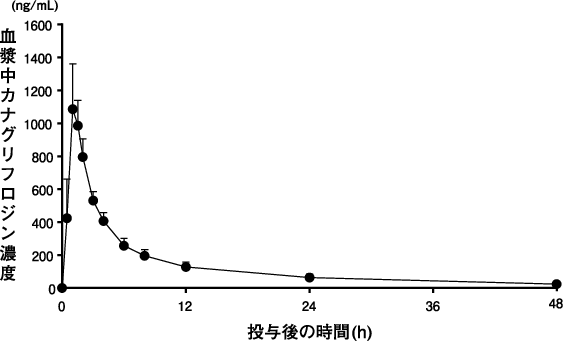
田辺三菱製薬(株):2型糖尿病患者を対象とした臨床薬理試験(社内資料)(2014年7月4日承認、CTD2.7.6.12)
4
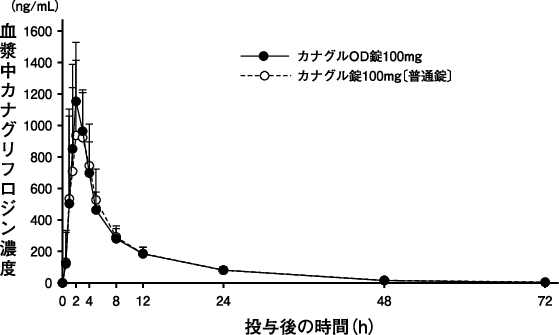
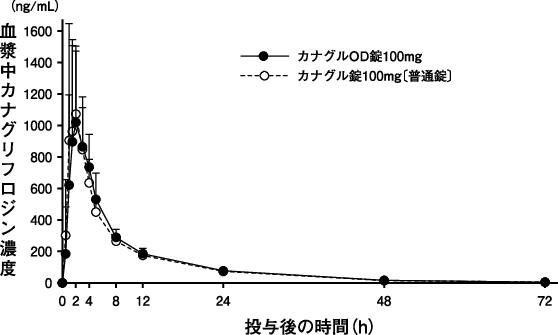
田辺三菱製薬(株):健康成人を対象としたOD錠及び普通錠の生物学的同等性試験(社内資料)(2024年3月15日承認、CTD2.7.6.1)
5
田辺三菱製薬(株):絶対バイオアベイラビリティ検討試験(社内資料)(2014年7月4日承認、CTD2.7.6.2)
6
田辺三菱製薬(株):健康成人を対象とした食事の影響試験(社内資料)(2014年7月4日承認、CTD2.7.6.1)
7
田辺三菱製薬(株):蛋白結合に関する検討(社内資料)(2014年7月4日承認、CTD2.6.4.4.2)
8
田辺三菱製薬(株):マスバランス試験(社内資料)(2014年7月4日承認、CTD2.7.6.11)
9
田辺三菱製薬(株):代謝に関する検討(社内資料)(2014年7月4日承認、CTD2.6.4.5.5、2.6.4.7.1)
10
田辺三菱製薬(株):トランスポーターに関する検討(社内資料)(2014年7月4日承認、CTD2.6.4.7.2)
11
田辺三菱製薬(株):腎機能障害者における薬物動態試験(社内資料)(2014年7月4日承認、CTD2.7.6.14)
12
田辺三菱製薬(株):肝機能障害者における薬物動態試験(社内資料)(2014年7月4日承認、CTD2.7.6.15)
13
田辺三菱製薬(株):第Ⅱ相用量設定試験(社内資料)(2014年7月4日承認、CTD2.7.6.41)
14
田辺三菱製薬(株):薬物相互作用試験(社内資料)(2014年7月4日承認、CTD2.7.2.2.3.2、2.7.2.2.5.1)
15
Inagaki N, et al.:Expert Opin Pharmacother. 2014;15(11):1501-1515
16
田辺三菱製薬(株):2型糖尿病患者を対象とした検証的試験(社内資料)(2014年7月4日承認、CTD2.7.6.42)
17
Inagaki N, et al.:J Diabetes Investig. 2015;6(2):210-218
18
田辺三菱製薬(株):2型糖尿病患者を対象とした長期投与試験(社内資料)(2014年7月4日承認、CTD2.7.6.53)
19
Yale JF, et al.:Diabetes obes metab. 2013;15(5):463-473
20
田辺三菱製薬(株):2型糖尿病における糖尿病性腎症第3期の患者を対象とした長期投与試験(社内資料)(2022年6月20日承認、CTD2.5)
21
田辺三菱製薬(株):インスリン製剤併用試験:二重盲検比較試験(社内資料)
22
Inagaki N, et al.:Cardiovasc Diabetol. 2016;15:89
23
田辺三菱製薬(株):インスリン製剤併用試験:長期投与試験(社内資料)
24
田辺三菱製薬(株):GLP-1受容体作動薬併用試験:長期投与試験(社内資料)
25
Mather A, Pollock C,:Kidney int. 2011;79(Suppl. 120):S1-S6
26
Heerspink HJL, et al.:Kidney Int. 2018;94:26-39
27
金崎啓造:日腎会誌 2019;61(4):465‒471
28
DeFronzo RA, et al.:Nat Rev Nephrol. 2021;17(5):319-334
29
Kuriyama C, et al.:J Pharmacol Exp Ther. 2014;351(2):423-431
30
田辺三菱製薬(株):in vitro及びin vivo薬理作用(社内資料)(2014年7月4日承認、CTD2.6.2.2.1、2.6.2.2.2)
31
田辺三菱製薬(株):糖尿病性腎症モデルマウスにおける薬理作用(社内資料)(2022年6月20日承認、CTD2.6.2.2.2)