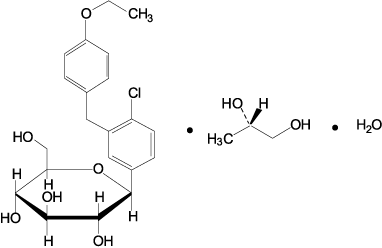
1
Henry RR, et al. Diabetes Obes Metab. 2017 Jun;19(6):814-821. doi: 10.1111/dom.12882
2
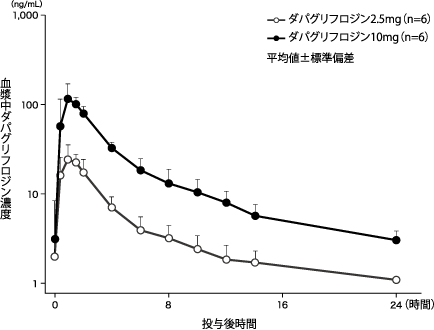
Kasichayanula S, et al. Diabetes Obes Metab. 2011 Apr;13(4):357-65. doi: 10.1111/j.1463-1326.2011.01359.x
3
社内資料(日本人1型糖尿病患者における薬物動態, 2017)
4
社内資料(生物学的同等性と食事の影響, 2010)
5
Boulton DW, et al. Br J Clin Pharmacol. 2013 Mar;75(3):763-8. doi: 10.1111/j.1365-2125.2012.04391.x
6
社内資料(蛋白結合率測定試験, 2010)
7
Kasichayanula S, et al. Br J Clin Pharmacol. 2013 Sep;76(3):432-44. doi: 10.1111/bcp.12056
8
Kasichayanula S, et al. Clin Ther. 2011 Nov;33(11):1798-808. doi: 10.1016/j.clinthera.2011.09.011
9
社内資料(腎、肝、小腸ミクロソームによるグルクロン酸抱合, 2009)
10
社内資料(In vivo代謝, 2008)
11
社内資料(CYPの誘導及び阻害並びにUGT1A1の阻害, 2011)
12
社内資料(糞尿中排泄率, 2006)
13
社内資料(トランスポーターへの影響, 2011)
14
社内資料(腎機能障害患者における薬物動態, 2010)
15
社内資料(肝機能障害患者における薬物動態, 2009)
16
Kasichayanula S, et al. Diabetes Obes Metab. 2011 Jan;13(1):47-54. doi: 10.1111/j.1463-1326.2010.01314.x
17
社内資料(ピオグリタゾンとの薬物相互作用, 2008)
18
Imamura A, et al. Diabetes Ther. 2013 Jun;4(1):41-9. doi: 10.1007/s13300-012-0016-5
19
社内資料(ヒドロクロロチアジドとの薬物相互作用, 2007)
20
Wilcox CS. J Am Heart Assoc. 2018;7(4):e007046. DOI: 10.1161/JAHA.117.007046
21
社内資料(バルサルタン及びシンバスタチンとの薬物相互作用, 2010)
22
Kasichayanula S, et al. Adv Ther. 2012 Feb;29(2):163-77. doi: 10.1007/s12325-011-0098-x
23
Kasichayanula S, et al. Diabetes Obes Metab. 2013 Mar;15(3):280-3. doi: 10.1111/dom.12024
24
Kaku K, et al. Diabetes Obes Metab. 2013 May;15(5):432-40. doi: 10.1111/dom.12047
25
社内資料(単独療法プラセボ対照比較試験, 2012)
26
Kaku K, et al. Diabetes Obes Metab. 2014 Nov;16(11):1102-10. doi: 10.1111/dom.12325
27
社内資料(単独又は併用療法による非盲検長期投与試験, 2013)
28
Kaku K, et al. Diabetes Ther. 2014 Dec;5(2):415-33. doi: 10.1007/s13300-014-0086-7
29
社内資料(外国人の中等度腎機能障害患者を対象としたプラセボ対照二重盲検試験, 2010)
30
Kohan DE, et al. Kidney Int. 2014 Apr;85(4):962-71. doi: 10.1038/ki.2013.356
31
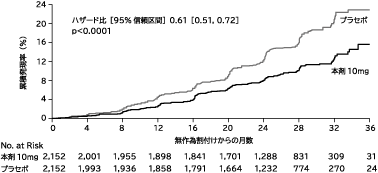
Mathieu C, et al. Diabetes Care. 2018 Sep;41(9):1938-46. doi: 10.2337/dc18-0623
32
社内資料(1型糖尿病患者を対象としたプラセボ対照二重盲検試験, 2018)
33
社内資料(1型糖尿病患者を対象とした非盲検長期投与試験, 2017)
34
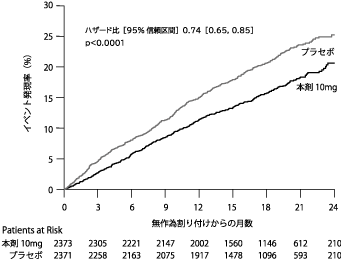
McMurray JJV, et al. N Engl J Med. 2019 Nov;381(21):1995-2008. doi: 10.1056/NEJMoa1911303
35
Solomon SD, et al. N Engl J Med. 2022 Sep;387(12):1089-98. doi: 10.1056/NEJMoa2206286
36
Jhund PS, et al. Nat.Med. 2022 Sep;28(9):1956-64. doi: 10.1038/s41591-022-01971-4
37
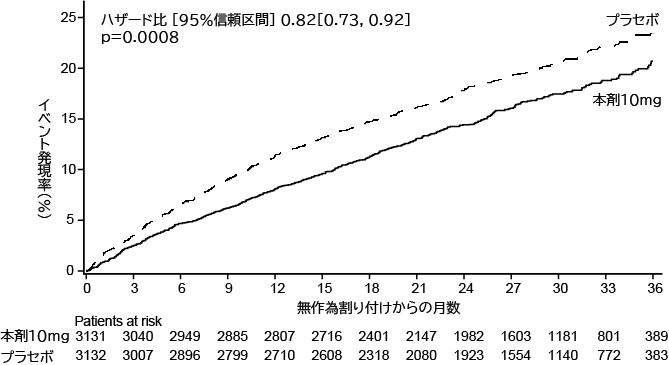
Heerspink HJL, et al. N Engl J Med. 2020 Oct;383(15):1436-46. doi: 10.1056/NEJMoa2024816
38
Araki E, et al. J Diabetes Investig. 2016 Jul;7(4):555-64. doi: 10.1111/jdi.12453
39
Araki E, et al. Diabetes Obes Metab. 2017 Apr;19(4):562-570. doi: 10.1111/dom.12853
40
Kanai Y, et al. J Clin Invest. 1994 Jan;93(1):397-404. doi: 10.1172/JCI116972
41
社内資料(SGLT2及びSGLT1に対するKi値及び選択性, 2011)
42
Verma S, et al. Diabetologia. 2018 Oct;61(10):2108-2117. doi: 10.1007/s00125-018-4670-7
43
社内資料(糖尿病性心不全モデルマウスにおける心保護作用, 2019)
44
Cherney DZI, et al. Lancet Diabetes Endocrinol. 2020 Jul;8(7):582-593. doi: 10.1016/S2213-8587(20)30162-5
45
Cherney DZ. et al. J Am Coll Cardiol. 2019 Nov 19;74(20):2511-2524. doi: 10.1016/j.jacc.2019.09.022
46
Wright EM, et al. J Intern Med. 2007 Jan;261(1):32-43. doi: 10.1111/j.1365-2796.2006.01746.x
47
社内資料(糖尿病モデルラットに単回投与後の尿中グルコース排泄量及び血漿中グルコース濃度, 2003)
48
社内資料(糖尿病モデルラットに反復投与後の尿中グルコース排泄量及び血漿中グルコース濃度, 2003)
49
社内資料(糖尿病モデルラットに単回投与後の血中グルコース濃度, 2003)
50
社内資料(前糖尿病性心不全モデルマウスにおける心保護作用, 2019)