1
社内資料:腎機能障害患者における薬物動態(承認年月日:2012年9月28日、CTD 2.7.6.3.6)
2
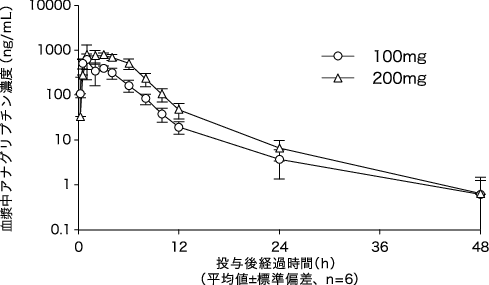
社内資料:健康成人における薬物動態:単回投与試験(承認年月日:2012年9月28日、CTD 2.7.6.3.1)
3
社内資料:健康成人における薬物動態:反復投与試験(承認年月日:2012年9月28日、CTD 2.7.6.3.2)
4
社内資料:健康成人における薬物動態に及ぼす食事の影響及びプロベネシドとの薬物相互作用(承認年月日:2012年9月28日、CTD 2.7.6.1.1及びCTD2.7.6.3.7)
5
社内資料:健康成人におけるマスバランス(承認年月日:2012年9月28日、CTD 2.7.6.3.3)
6
社内資料:非臨床試験-薬物動態試験:分布(承認年月日:2012年9月28日、CTD 2.6.4.4)
7
社内資料:非臨床試験-薬物動態試験:代謝(承認年月日:2012年9月28日、CTD 2.6.4.5及びCTD 2.6.4.7.1)
8
社内資料:非臨床試験-薬物動態試験:排泄(承認年月日:2012年9月28日、CTD 2.6.4.6、CTD 2.6.4.7.2及びCTD 2.6.4.7.3)
9
社内資料:肝機能障害患者における薬物動態(承認年月日:2012年9月28日、CTD 2.7.6.3.5)
10
社内資料:第Ⅱ相試験(承認年月日:2012年9月28日、CTD 2.7.6.5.1及びCTD 2.7.2.3.2.5)
11
社内資料:ミグリトールとの薬物相互作用(承認年月日:2012年9月28日、CTD 2.7.6.3.8)
12
社内資料:グリベンクラミドとの薬物相互作用(承認年月日:2012年9月28日、CTD 2.7.6.3.12)
13
社内資料:ジゴキシンとの薬物相互作用(承認年月日:2012年9月28日、CTD 2.7.6.3.10)
14
社内資料:メトホルミンとの薬物相互作用(承認年月日:2012年9月28日、CTD 2.7.6.3.9)
15
社内資料:ピオグリタゾンとの薬物相互作用(承認年月日:2012年9月28日、CTD 2.7.6.3.13)
16
社内資料:シクロスポリンとの薬物相互作用(承認年月日:2012年9月28日、CTD 2.7.6.3.11)
17
社内資料:第Ⅱ/Ⅲ相試験 単独療法(承認年月日:2012年9月28日、CTD 2.7.6.5.2)
18
社内資料:第Ⅲ相試験 単独療法長期投与(承認年月日:2012年9月28日、CTD 2.7.6.5.3)
19
社内資料:α-グルコシダーゼ阻害剤又はチアゾリジン系薬剤併用試験(承認年月日:2012年9月28日、CTD 2.7.6.5.4)
20
社内資料:スルホニルウレア剤又はビグアナイド系薬剤併用試験(承認年月日:2012年9月28日、CTD 2.7.6.5.5)
21
社内資料:速効型インスリン分泌促進剤併用試験(承認年月日:2015年12月21日、CTD 2.7.6.5.7)
22
社内資料:インスリン製剤併用試験(承認年月日:2015年12月21日、CTD 2.7.6.5.1)
23
Drucker DJ, et al.:Lancet. 2006;368(9548):1696-1705
24
Vilsbøll T, et al.:J Clin Endocrinol Metab. 2003;88(1):220-224
25
社内資料:DPP-4に対する阻害作用の検討(承認年月日:2012年9月28日、CTD 2.6.2.2.1)
26
社内資料:Zucker fattyラットにおける耐糖能改善作用の検討(承認年月日:2012年9月28日、CTD 2.6.2.2.9)
27
社内資料:GKラットにおける耐糖能改善作用の検討(承認年月日:2012年9月28日、CTD 2.6.2.2.10)