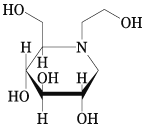
1
保存期の腎機能低下患者における薬物動態(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(17))
2
生殖発生毒性試験(ウサギ)(セイブル錠:2005年10月11日承認、申請資料概要2.6.6.6)
3
生殖発生毒性試験(ラット)(セイブル錠:2005年10月11日承認、申請資料概要2.6.6.6)
4
産褥期健康成人女性における薬物動態及び乳汁移行(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(12))
5
健康成人における薬物動態の用量反応Ⅰ(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(5))
6
健康成人における薬物動態の用量反応Ⅱ(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(6))
7
健康成人における生物学的利用能に及ぼす食事の影響(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅰ(1))
8
健康成人における反復投与時の薬物動態(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(7))
9
2型糖尿病における薬物動態(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(13))
10
Ahr, H. J. et al.:Arzneim-Forsch., 1997;47:734-745
11
肝薬物代謝酵素系に対する阻害作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(4))
12
ラット肝薬物代謝酵素に対する影響-7日間経口投与試験-(セイブル錠:2005年10月11日承認、申請資料概要2.6.4.5)
13
透析患者における薬物動態(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(16))
14
グリベンクラミドとの薬物相互作用Ⅰ(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(18))
15
グリベンクラミドとの薬物相互作用Ⅱ(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(19))
16
メトホルミンとの薬物相互作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(20))
17
Weber, H. et al.:Eur. J. Clin. Pharmacol., 1989;36(Suppl.):11
18
ジゴキシンとの薬物相互作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(22))
19
プロプラノロールとの薬物相互作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(23))
20
ラニチジンとの薬物相互作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(27))
21
ニフェジピンとの薬物相互作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(24))
22
Schall, R. et al.:Arzneim-Forsch., 1996;46:41-46
23
Richardt, D. et al.:Clin. Drug Invest., 1997;13:171-174
24
制酸剤との薬物相互作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅱ(28))
25
村上晴美他:診療と新薬, 2017;54:460-482
26
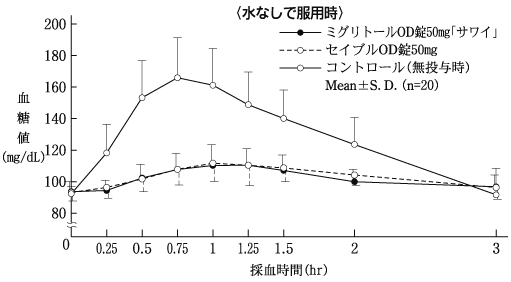
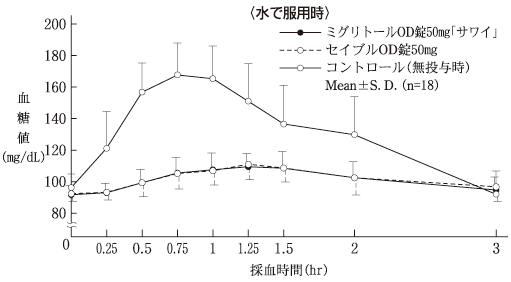
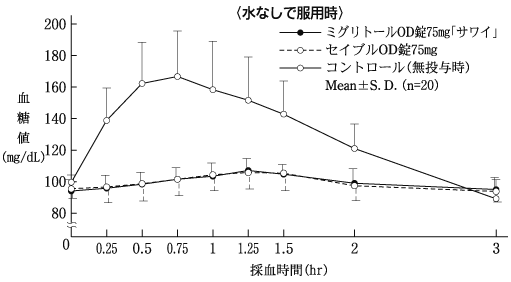
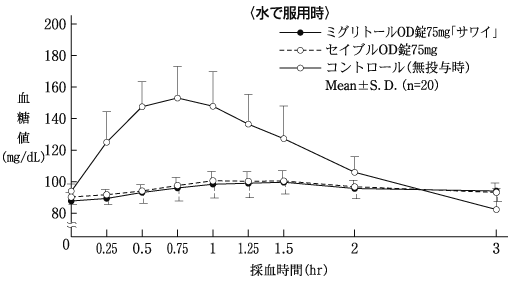
社内資料:生物学的同等性試験(OD錠25mg)
27
Kawamori, R. et al.:Diabetes Metab., 2003;29:4S263
28
食事・運動療法への追加療法(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅲ(3))
29
田嶼尚子他:薬理と治療, 2006;34:79-90
30
スルホニルウレア剤併用試験(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 Ⅲ(5))
31
ビグアナイド剤併用試験(セイブル錠:2009年11月6日承認、審査報告書)
32
Nemoto, M. et al.:Acta Diabetol., 2011;48:15-20
33
インスリン併用試験<2型糖尿病>(セイブル錠:2008年12月22日承認、審査報告書)
34
Kubo, S. et al.:J. Diabetes Invest., 2010;1:60-65
35
インスリン併用試験<1型糖尿病>(セイブル錠:2008年12月22日承認、審査報告書)
36
二糖類水解酵素に対する阻害作用(セイブル錠:2005年10月11日承認、申請資料概要2.6.2.2)
37
Samulitis, B. K. et al.:Drugs Exp. Clin. Res., 1987;13:517-524
38
塚本桂他:薬理と治療, 2001;29:623-633
39
Goda, T. et al.:Br. J. Nutr., 2007;98:702-710
40
Osonoi, T. et al.:Diabetes Metab., 2003;29:4S263-4S264