作成又は改訂年月
2018年2月改訂
(第7版 承認条件解除)
※
2014年4月改訂
日本標準商品分類番号
日本標準商品分類番号等
効能又は効果追加承認年月(最新) ※
薬効分類名
承認等
販売名
ボグリボースOD錠0.2mg「マイラン」
販売名コード
承認・許可番号
承認番号 22100AMX01963
商標名 Voglibose OD Tablets
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯 法
気密容器、室温保存
使用期限
3年
規制区分
処方箋医薬品
注意−医師等の処方箋により使用すること
組成
成分・含量(1錠中)
日局 ボグリボース 0.2mg
添加物
D-マンニトール、クロスポビドン、軽質無水ケイ酸、黄色三二酸化鉄、ステアリン酸マグネシウム
性状
帯黄白色の割線入りの素錠である。
外形
裏
側面
直径(mm)
6.5
厚さ(mm)
2.5
質量(mg)
100
識別コード
M652
販売名
ボグリボースOD錠0.3mg「マイラン」
販売名コード
承認・許可番号
承認番号 22100AMX01964
商標名 Voglibose OD Tablets
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯 法
気密容器、室温保存
使用期限
3年
規制区分
処方箋医薬品
注意−医師等の処方箋により使用すること
組成
成分・含量(1錠中)
日局 ボグリボース 0.3mg
添加物
D-マンニトール、クロスポビドン、軽質無水ケイ酸、黄色三二酸化鉄、ステアリン酸マグネシウム
性状
微黄白色の素錠である。
外形
裏
側面
直径(mm)
7.0
厚さ(mm)
2.5
質量(mg)
120
識別コード
M653
一般的名称
禁忌
重症ケトーシス、糖尿病性昏睡又は前昏睡の患者〔輸液及びインスリンによる速やかな高血糖の是正が必須となるので本剤の投与は適さない。〕
重症感染症、手術前後、重篤な外傷のある患者〔インスリン注射による血糖管理が望まれるので本剤の投与は適さない。〕
本剤の成分に対する過敏症の既往歴のある患者
効能又は効果
効能又は効果に関連する使用上の注意
※ 耐糖能異常における2型糖尿病の発症抑制の場合(0.2mgのみ)
本剤の適用は、耐糖能異常(空腹時血糖が126mg/dL未満かつ75g経口ブドウ糖負荷試験の血糖2時間値が140〜199mg/dL)と判断され、糖尿病発症抑制の基本である食事療法・運動療法を3〜6ヵ月間行っても改善されず、かつ高血圧症、脂質異常症(高トリグリセリド血症、低HDLコレステロール血症等)、肥満(Body Mass Index:BMI25kg/m2
○糖尿病の食後過血糖の改善
※
用法及び用量
○糖尿病の食後過血糖の改善の場合
通常、成人にはボグリボースとして1回0.2mgを1日3回毎食直前に経口投与する。なお、効果不十分な場合には、経過を十分に観察しながら1回量を0.3mgまで増量することができる。
※ 耐糖能異常における2型糖尿病の発症抑制の場合(0.2mgのみ)
通常、成人にはボグリボースとして1回0.2mgを1日3回毎食直前に経口投与する。
用法及び用量に関連する使用上の注意
※ 全効能共通
本剤は口腔内で崩壊するが、口腔の粘膜から吸収されることはないため、唾液又は水で飲み込むこと。(「適用上の注意」の項参照)
※ 耐糖能異常における2型糖尿病の発症抑制の場合(0.2mgのみ)
本剤投与中は適切な間隔で血糖管理に関する検査を行い、常に投与継続の必要性に注意すること。(「重要な基本的注意」の項参照)
使用上の注意
慎重投与
他の糖尿病用薬を投与中の患者〔低血糖が起こることがある。〕(「重大な副作用」の項参照)
開腹手術の既往又は腸閉塞の既往のある患者〔腸内ガス等の増加により腸閉塞が発現しやすい。〕
消化・吸収障害を伴った慢性腸疾患の患者〔本剤の作用により病態が悪化することがある。〕
ロエムヘルド症候群、重度のヘルニア、大腸の狭窄・潰瘍等の患者〔腸内ガス等の増加により症状が悪化することがある。〕
重篤な肝障害のある患者〔代謝状態が変化することがあるため血糖管理状況が大きく変化するおそれがある。また、重篤な肝硬変例で、高アンモニア血症が増悪し意識障害を伴うことがある。〕
重篤な腎障害のある患者〔代謝状態が変化することがあるため血糖管理状況が大きく変化するおそれがある。〕
高齢者(「高齢者への投与」の項参照)
重要な基本的注意
※ 全効能共通
※
※
※
※ 糖尿病の食後過血糖の改善の場合
糖尿病治療の基本である食事療法・運動療法のみを行っている患者では、投与の際の食後血糖2時間値は200mg/dL以上を示す場合に限る。
食事療法、運動療法に加えて経口血糖降下剤又はインスリン製剤を使用している患者では、投与の際の空腹時血糖値は140mg/dL以上を目安とする。
本剤投与中は、血糖を定期的に検査するとともに、経過を十分に観察し、常に投与継続の必要性について注意を払うこと。本剤を2〜3カ月投与しても食後血糖に対する効果が不十分な場合(静脈血漿で食後血糖2時間値が200mg/dL以下にコントロールできないなど)には、より適切と考えられる治療への変更を考慮すること。
※ 耐糖能異常における2型糖尿病の発症抑制の場合
本剤の投与開始後は、1〜3ヵ月毎を目安に空腹時血糖、随時血糖、HbA1c等の糖代謝関連検査及び体重測定を実施するとともに、6〜12ヵ月毎を目安に75g経口ブドウ糖負荷試験を実施して十分に経過観察し、常に投与継続の必要性に留意すること。また、血糖高値(空腹時血糖、75g経口ブドウ糖負荷試験の血糖2時間値)や糖負荷後初期インスリン分泌低下等を有する場合には、糖尿病発症リスクが高くなるとの報告があるので、十分な観察を行うこと。
相互作用
併用注意
薬剤名等 臨床症状・措置方法 機序・危険因子 糖尿病用薬 インスリン及びスルホニルウレア系薬剤と併用した際に、低血糖発現の報告があるので、上記薬剤との併用時には、低血糖発現の可能性を考慮し、低用量から投与を開始するなど慎重に投与すること。 糖尿病用薬及びその血糖降下作用を増強又は減弱する薬剤を併用している場合β −遮断剤 上記の併用に加え更に本剤を併用する場合には、糖尿病用薬の使用上の注意に記載の相互作用に留意するとともに、本剤の糖質吸収遅延作用が加わることによる影響に十分注意すること。
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用(頻度不明)
他の糖尿病用薬との併用で低血糖 があらわれることがある。また、他の糖尿病用薬を併用しない場合でも低血糖 が報告されている。本剤は二糖類の消化・吸収を遅延するので、低血糖症状が認められた場合にはショ糖ではなくブドウ糖を投与するなど適切な処置を行うこと。
腹部膨満、鼓腸、放屁増加等があらわれ、腸内ガス等の増加により、腸閉塞 があらわれることがあるので、観察を十分に行い、持続する腹痛、嘔吐等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。
劇症肝炎 、AST(GOT)、ALT(GPT)の上昇等を伴う重篤な肝機能障害、黄疸 があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
重篤な肝硬変例に投与した場合 、便秘等を契機として高アンモニア血症が増悪し、意識障害 を伴うことがあるので、排便状況等を十分に観察し、異常が認められた場合には直ちに投与を中止するなど適切な処置を行うこと。
その他の副作用
消化器
(頻度不明)
下痢、放屁、腹部膨満、軟便、腹鳴、腹痛、便秘、食欲不振、悪心、嘔吐、胸やけ、口渇、口内炎、味覚異常、腸管嚢胞様気腫症
過敏症 注)
(頻度不明)
発疹、そう痒、光線過敏症
肝臓
(頻度不明)
AST(GOT)、ALT(GPT)、LDH、γ-GTP、Al-Pの上昇
精神神経系
(頻度不明)
めまい、頭痛、ふらつき、眠気
血液
(頻度不明)
顆粒球減少、貧血、血小板減少
その他
(頻度不明)
しびれ、顔面等の浮腫、眼のかすみ、ほてり、倦怠感、脱力感、高カリウム血症、血清アミラーゼ上昇、HDLコレステロール低下、発汗、脱毛
その他の副作用の注意
高齢者への投与
一般に高齢者では生理機能が低下しているので、低用量(例えば1回量0.1mg)から投与を開始するとともに、血糖値及び消化器症状の発現に留意するなど、経過を十分に観察しながら慎重に投与すること。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には治療上の有益性が危険性を上まわると判断される場合にのみ投与すること。〔妊娠中の投与に関する安全性は確立していない。〕
授乳中の婦人への投与は避けることが望ましいが、やむを得ず投与する場合は、授乳を避けさせること。〔動物試験(ラット)で、母動物の糖質吸収の抑制に起因する乳汁産生の抑制によると考えられる出生児の体重の増加抑制が認められている。〕
小児等への投与
小児に対する安全性は確立していない(使用経験がない)。
適用上の注意
1 薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。〔PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。〕
2 服用時
本剤は舌の上にのせ唾液を浸潤させ舌で軽くつぶし、崩壊後唾液のみで服用可能である。また、水で服用することもできる。
薬効薬理
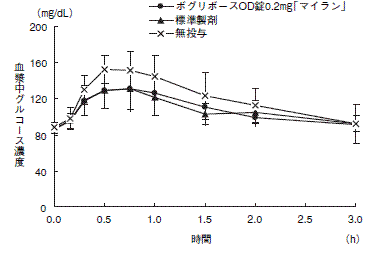
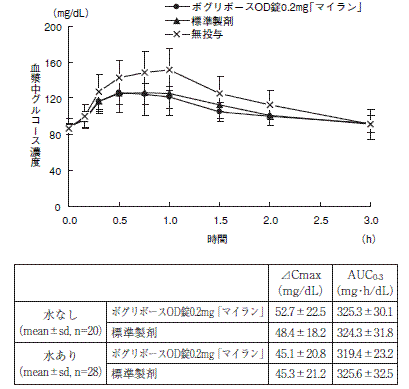
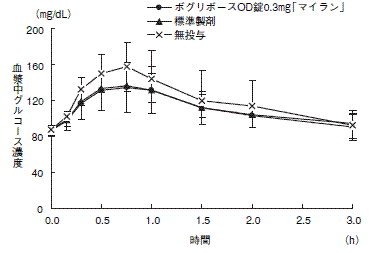
1 生物学的同等性試験
<ボグリボースOD錠0.2mg「マイラン」>
ボグリボースOD錠0.2mg「マイラン」と標準製剤を、それぞれ3錠 (ボグリボースとして0.6mg)健康成人男子(水なし20名、水あり28名)に絶食単回経口投与し、無投与群を含む3群に対し、ショ糖負荷 (100g) における血漿中グルコース濃度を経時的に測定した。得られたパラメータ (AUC、ΔCmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。
1) 水なし
水あり
血漿中グルコース濃度並びにAUC、ΔCmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
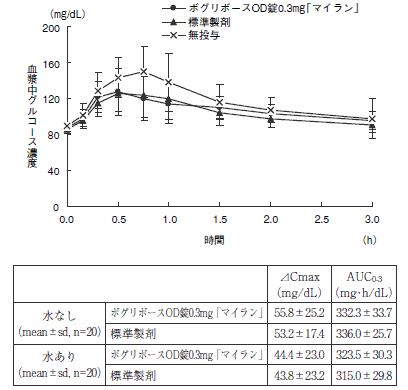
<ボグリボースOD錠0.3mg「マイラン」>
ボグリボースOD錠0.3mg「マイラン」と標準製剤を、それぞれ2錠 (ボグリボースとして0.6mg)健康成人男子(水なし20名、水あり20名)に絶食単回経口投与し、無投与群を含む3群に対し、ショ糖負荷 (100g) における血漿中グルコース濃度を経時的に測定した。得られたパラメータ (AUC、ΔCmax) について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。
2) 水なし
水あり
血漿中グルコース濃度並びにAUC、ΔCmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
2 薬理作用
腸管において、二糖類から単糖類への分解を担う二糖類水解酵素(α -グルコシダーゼ)を阻害することによって、糖質の消化・吸収を遅延させ、食後過血糖を改善する。3)
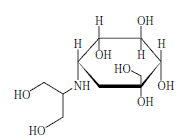
有効成分に関する理化学的知見
一般名
〔日局〕 ボグリボース (Voglibose)
化学名
3,4‐Dideoxy‐4‐[2‐hydroxy‐1‐(hydroxymethyl)ethylamino]‐2‐C ‐(hydroxymethyl)‐D‐epi ‐inositol
分子式
C10 H21 NO7
分子量
267.28
構造式
性 状
本品は白色の結晶又は結晶性の粉末である。
融 点
163〜168℃
取扱い上の注意
安定性試験
加速試験(40℃、相対湿度75%、6ヵ月)の結果、ボグリボースOD錠0.2mg「マイラン」及びボグリボースOD錠0.3mg「マイラン」は通常の市場流通下において3年間安定であることが推測された。4),5)
包装
ボグリボースOD錠0.2mg「マイラン」 PTP 100錠(10錠×10) 500錠(10錠×50)
ボグリボースOD錠0.3mg「マイラン」 PTP 100錠(10錠×10) 500錠(10錠×50)
主要文献及び文献請求先
主要文献
1
社内資料 (0.2mg:生物学的同等性試験資料)
2
社内資料 (0.3mg:生物学的同等性試験資料)
3
第十七改正日本薬局方解説書:C-5141,廣川書店,2016
4
社内資料 (0.2mg:安定性試験資料)
5
社内資料 (0.3mg:安定性試験資料)
文献請求先
「主要文献」に記載の社内資料につきましても下記にご請求ください。
〒151-8589 東京都渋谷区代々木3-22-7
学術情報ダイヤル 0120-664-467
FAX 03-3379-3053
製造業者又は輸入販売業者の氏名又は名称及び住所
製造販売元
マイラン製薬株式会社
大阪市中央区本町2丁目6番8号
販売
ファイザー株式会社
東京都渋谷区代々木3-22-7
※保険給付上の注意
耐糖能異常における2型糖尿病の発症抑制(ただし、食事療法及び運動療法を十分に行っても改善されない場合に限る。)を目的に使用する場合、保険適用上の取扱いを以下のとおりとすること。
耐糖能異常(空腹時血糖が126mg/dL未満かつ75g経口ブドウ糖負荷試験の血糖2時間値が140〜199mg/dL)と判断され、糖尿病発症抑制の基本である食事療法及び運動療法を3〜6ヵ月間行っても改善されず、かつ高血圧症、脂質異常症(高トリグリセリド血症、低HDLコレステロール血症等)のいずれかを基礎疾患として有する患者を対象とする場合に限り、保険適用されるものとする。
診療報酬明細書の摘要欄には、耐糖能異常と判断した根拠(判断した年月日とその結果)、食事療法及び運動療法を3〜6ヵ月間行っても改善されなかった旨及び高血圧症又は脂質異常症の診断名を記載する。