1
社内資料: 生物学的同等性試験
2
日本泌尿器学会ほか: 尿路結石症診療ガイドライン2013年版. 金原出版; 2013: 114-116
アルカリ化療法剤−酸性尿・アシドーシス改善−
1g 6.5円
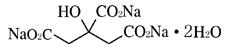
有効成分 | 1g中、乾燥質量として クエン酸カリウム 463mg 日局 クエン酸ナトリウム水和物 390mg |
|---|---|
添加剤 | 無水クエン酸、乳糖水和物、黄色5号、香料 |
| 外形 | 分包品(1g)はヒートシール包装 |
|---|---|
| 性状 | 淡橙色の粉末~粒で、芳香があり、清涼な塩味 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
ヘキサミン (ヘキサミン静注液) | ヘキサミンの効果を減弱することがあるので併用は避けること。 | ヘキサミンは酸性尿下で効果を発現するので、尿pHの上昇により効果が減弱することがある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
水酸化アルミニウムゲル | 他のクエン酸製剤との併用でアルミニウムの吸収が促進されたとの報告があるので、併用する場合には2時間以上投与間隔を置くこと。 | クエン酸がアルミニウムとキレート化合物を形成し、アルミニウムの吸収を促進させるとの報告がある。 |
0.1%~2%未満 | 頻度不明 | |
|---|---|---|
肝臓 | AST上昇、ALT上昇、Al-P上昇、γ-GTP上昇 | LDH上昇 |
腎臓 | 血中クレアチニン上昇、BUN上昇 | |
消化器 | 胃不快感、下痢、悪心、胸やけ、嘔吐、食欲不振 | 嘔気、口内炎、腹部膨満感、胃痛、舌炎 |
皮膚 | 発疹 | そう痒感 |
泌尿器 | 排尿障害注) | |
その他 | 頻脈、残尿感、眠気 | 貧血、全身倦怠感 |
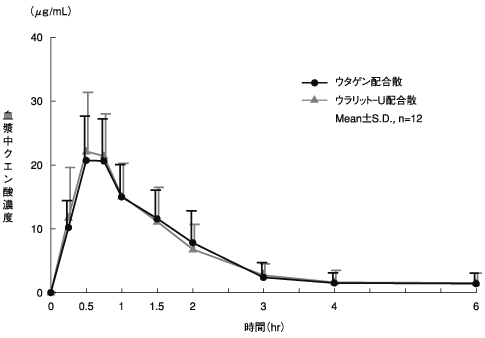
判定パラメータ | 参考パラメータ | |||
AUC(0→6) (μg・hr/mL) | Cmax (μg/mL) | Tmax (hr) | t1/2 (hr) | |
ウタゲン配合散 | 36.2±11.6 | 22.4±6.1 | 0.6±0.1 | 1.2±0.6 |
ウラリット-U配合散 | 36.7±14.1 | 23.9±7.8 | 0.8±0.4 | 1.3±0.7 |
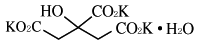
 0120-189-228
0120-189-228