| 色・剤形 | 淡黄白色の錠剤 |
|---|---|
| 外形 |  |
| 大きさ(mm) | 直径:8.0 厚さ:3.5 |
| 重量(mg) | 180.0 |
| 識別コード | KCC F01 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| テガフール・ギメラシル・オテラシルカリウム配合剤(ティーエスワン) | 早期に重篤な血液障害や下痢、口内炎等の消化管障害等が発現するおそれがあるので、テガフール・ギメラシル・オテラシルカリウム配合剤投与中及び投与中止後少なくとも7日以内は本療法を施行しないこと。 | ギメラシルがフルオロウラシルの異化代謝を阻害し、血中フルオロウラシル濃度が著しく上昇する。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| フェニトイン | フェニトイン中毒(嘔気・嘔吐、眼振、運動障害等)が発現することがある。必要に応じてフェニトインの血中濃度を測定し、フェニトインの用量調節を行い、注意して投与すること。異常が認められた場合には本療法を中止するなど適切な処置を行うこと。 | テガフールによってフェニトインの代謝が抑制され、フェニトインの血中濃度が上昇する。 |
| ワルファリンカリウム | テガフールがワルファリンカリウムの作用を増強することがあるので、凝固能の変動に注意すること。 | 機序は不明である。 |
| 他の抗悪性腫瘍剤、放射線照射 | 消化管障害、血液障害等の副作用が増強することがあるので、患者の状態を十分に観察すること。異常が認められた場合には減量、休薬等の適切な処置を行うこと。 | 副作用が相互に増強される。 |
| 葉酸代謝拮抗剤(スルファメトキサゾール・トリメトプリム等) | これらの薬剤の作用が減弱することがある。 | ホリナートによって葉酸代謝拮抗作用が減弱するためと考えられる。 |
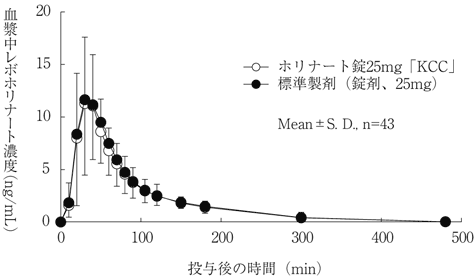
| 判定パラメータ AUC0-480 (ng・min/mL) | 判定パラメータ Cmax (ng/mL) | 参考パラメータ Tmax (min) | 参考パラメータ T1/2 (min) | |
| ホリナート錠25mg「KCC」 | 944.06±307.07 | 12.43±5.85 | 38.1±15.9 | 103.2±53.5 |
| 標準製剤 (錠剤、25mg) | 986.14±355.29 | 13.40±6.60 | 37.9±13.7 | 112.0±64.7 |