1
Shirao, K. et al.:J. Clin. Oncol. 2004;22(17):3466-3474
2
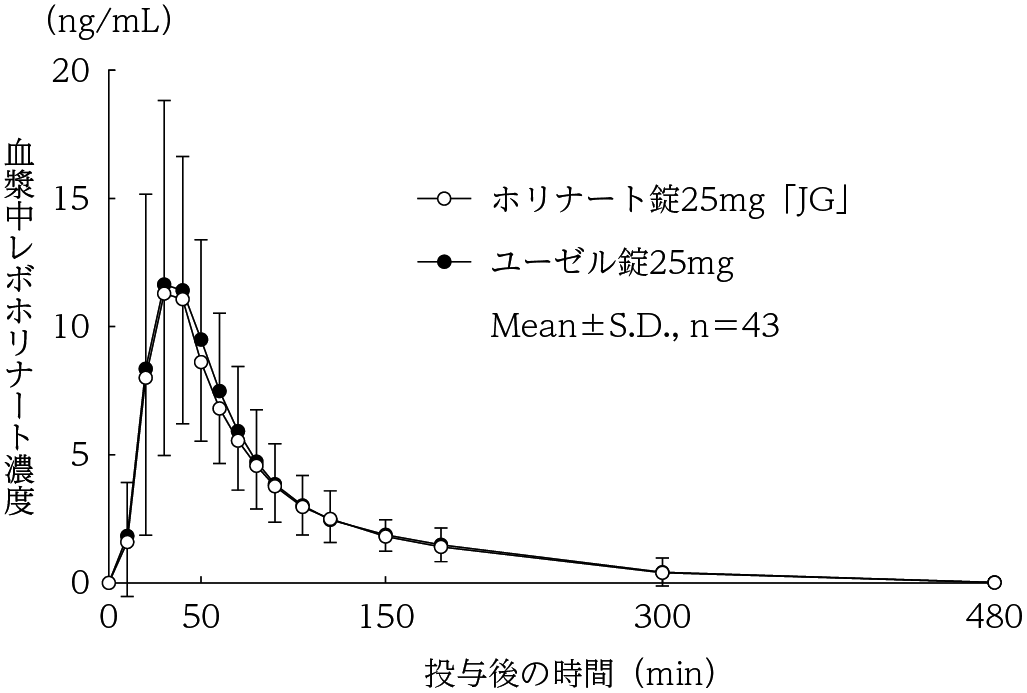
社内資料:生物学的同等性試験
3
Damle, B. et al.:Clin. Cancer Res. 2001;7(3):517-523
4
臨床試験の経緯と概略(ユーゼル錠:2003年7月17日承認、申請資料概要 ト.1)
5
ブリッジング試験(ユーゼル錠:2003年7月17日承認、申請資料概要 ト.3)
6
Douillard, J. -Y. et al.:J. Clin. Oncol. 2002;20(17):3605-3616
7
臨床第Ⅲ相試験(ユーゼル錠:2003年7月17日承認、申請資料概要 ト.2.(1))
8
Carmichael, J. et al.:J. Clin. Oncol. 2002;20(17):3617-3627
9
作用機序(ユーゼル錠:2003年7月17日承認、申請資料概要 ホ)
10
ヒト結腸癌細胞株COLO205における5-fluorouracilの抗腫瘍効果に対するLV及び5-methyltetrahydrofolateの効果増強濃度検討(in vitro)(ユーゼル錠:2003年7月17日承認、申請資料概要 ホ.1.(5))
11
ヒト結腸癌株KM20Cのヌードマウス皮下移植モデルにおけるUFTの抗腫瘍効果に対するLV併用投与による効果増強用量の検討(ユーゼル錠:2003年7月17日承認、申請資料概要 ホ.1.(1))
12
ヒト大腸癌株のヌードマウス皮下移植モデルにおけるUFTの抗腫瘍効果に対するLV併用投与による効果増強の検討(ユーゼル錠:2003年7月17日承認、申請資料概要 ホ.1.(2))